Зеленый синтез металлов и наночастиц оксидов металлов и их влияние на одноклеточную водоросль Chlamydomonas reinhardtii
Аннотация
В последнее время зеленый синтез металлических наночастиц привлек широкое внимание из-за его возможности и очень низкого воздействия на окружающую среду. Этот подход был применен в данном исследовании для синтеза наноразмерных материалов из золота (Au), платины (Pt), палладия (Pd), серебра (Ag) и оксида меди (CuO) в простых водных средах с использованием натурального полимера карайи в качестве восстановителя и стабилизирующий агент. Дзета-потенциал, стабильность и размер наночастиц (НЧ) были охарактеризованы с помощью Zetasizer Nano, УФ-видимой спектроскопии и электронной микроскопии. Более того, биологический эффект НЧ (диапазон концентраций 1,0–20,0 мг / л) на одноклеточную зеленую водоросль ( Chlamydomonas reinhardtii ) исследовали путем оценки роста водорослей, целостности мембран, окислительного стресса, хлорофилла ( Chl ) флуоресценция и фотосинтетическая эффективность фотосистемы II. Полученные НЧ имели средний размер 42 (Au), 12 (Pt), 1,5 (Pd), 5 (Ag) и 180 (CuO) нм и показали высокую стабильность в течение 6 месяцев. При концентрациях 5 мг / л НЧ Au и Pt лишь незначительно снижали рост водорослей, в то время как НЧ Pd, Ag и CuO полностью подавляли рост. НЧ Ag, Pd и CuO проявили сильные биоцидные свойства и могут использоваться для предотвращения появления водорослей в плавательных бассейнах (CuO) или в других антимикробных приложениях (Pd, Ag), тогда как Au и Pt не обладают этими свойствами и могут быть отнесены к категории безвредных для зеленых водорослей. .
Фон
Наночастицы металлов и оксидов металлов (НЧ) привлекли значительное внимание исследователей из-за их исключительных электрических, оптических, магнитных и каталитических свойств. Это позволило их широко использовать в различных промышленных, медицинских, сельскохозяйственных и экологических приложениях, а дальнейшее использование постоянно находится в стадии разработки [1,2,3,4]. Традиционные методы синтеза чистых наночастиц металлов и оксидов металлов включают восстанавливающие и стабилизирующие химические агенты, которые токсичны для людей и других видов на различных трофических уровнях [5,6,7,8,9,10,11]. В ответ исследователи сейчас ищут альтернативные подходы к «зеленому синтезу», чтобы уменьшить или устранить вредные химические вещества при производстве НЧ [12,13,14,15,16,17,18].
Во многих исследованиях сообщается о широком спектре применений НЧ металлов и оксидов металлов благодаря их уникальным и широким спектрам физико-химических свойств [19]. Например, НЧ серебра (Ag) широко используются в медицине, текстиле, упаковке пищевых продуктов и водоочистке [20,21,22,23]. НЧ золота (Au) используются в биомедицинских исследованиях, а НЧ платины (Pt) широко используются в промышленности благодаря своим каталитическим свойствам [24, 25]. Наконец, НЧ палладия (Pd) использовались в качестве катализаторов при производстве фармацевтических препаратов [26, 27], а НЧ оксида меди (CuO) в качестве противообрастающих агентов в красках и тканях благодаря их доказанным антибактериальным свойствам [28]. Металлические НЧ могут служить катализаторами разложения широкого спектра распространенных загрязнителей окружающей среды, включая полихлорированные бифенилы (ПХБ), галогенированные алифатические соединения, хлорорганические пестициды, токсичные металлы и галогенированные органические растворители [29]. НЧ CuO, Ag и Au также используются для обнаружения ядовитых газов, таких как оксид углерода (CO), цианистый водород (HCN) и диоксид серы (SO 2 ) [30, 31]. В последнее время ряд наночастиц металлов (Au, Ag и Cu), которые демонстрируют локализованный поверхностный плазмонный резонанс, были использованы при разработке бионаносенсоров [24].
К сожалению, наночастицы металлов и оксидов металлов могут отрицательно влиять как на здоровье человека, так и на окружающую среду в целом, например за счет генерирования новых классов токсинов, которые могут отрицательно влиять на микробные сообщества, что оказывает влияние на всю экосистему [32,33,34,35]. В результате влияние НЧ на микроорганизмы стало широко изучаться. Например, было показано, что НЧ серебра подавляют рост водорослей и фотосинтез, изменяя хлорофилл ( Chl ) флуоресцентное содержание Chlamydomonas reinhardtii [36], изменяя рост клеток Thalassiosira pseudonana и Synechococcus sp. [37] и влияя на рост и жизнеспособность клеток водных растений ряска набухшая Lemna gibba [38] . Ksiyk et al. [39] и Соренсен и др. [40] сообщили о том, что НЧ Pt ингибируют рост пресноводных микроводорослей Pseudokirchneriella subcapitata [39, 40]. Неудивительно, что как Ag, так и Pd НЧ применялись в качестве полезных антибактериальных агентов против множества грамположительных и грамотрицательных бактерий [41,42,43]. Напротив, считается, что наночастицы золота не оказывают отрицательного воздействия на бактерии или водоросли [44, 45], хотя одно исследование показало, что они могут быть токсичными, в зависимости от их заряда и химического состава поверхности [46]. Сообщалось об отрицательном воздействии на НЧ CuO на C. Reinhardtii [36, 47], п. subcapitata [48], водоросли западные Elodea nuttallii [49] ряска Lemna sp . , Дафния великая [48] и ранние стадии жизни рыбок данио Danio rerio [50, 51].
НЧ металлов обладают физическими и химическими свойствами, которые могут вызывать повреждение клеток, например из-за чрезмерного образования активных форм кислорода (АФК) с последующим повреждением ДНК, белков и липидов. Образование АФК НЧ Ag обнаружено у Chlorella vulgaris и Dunaliella tertiolecta культур и в L. гибба [52], а также у бактерий [53]. НЧ CuO и Fe способны генерировать водородные радикалы, семейство АФК, образующихся в результате реакции Фентона, которые могут нанести вред множеству водных и наземных организмов [54, 55].
Зеленая химия - это набор принципов или практик, которые поощряют разработку продуктов и процессов, которые сокращают или исключают использование и образование опасных веществ [56,57,58]. Современные практики «зеленых» нанотехнологий часто включают использование природных источников, неопасных растворителей, биоразлагаемых и биосовместимых материалов и энергоэффективных процессов при получении НЧ [59]. Например, биополимеры, такие как целлюлоза, хитозан, декстран или древесные камеди, часто используются в качестве восстанавливающих и стабилизирующих агентов для синтеза НЧ металлов [12, 60, 61, 62]. Камедь карая (GK), использованная в этом исследовании, представляет собой камедь натурального дерева из Sterculia . состоящий приблизительно из 13–26% галактозы и 15–30% рамнозы, 30–43% галактуроновой кислоты, 37% остатков уроновой кислоты и около 8% ацетильных групп [63]. Токсикологические исследования доказали, что ГК нетоксичен, что позволяет использовать его даже в качестве пищевой добавки [62,63,64,65].
В этом исследовании мы стремились использовать подход зеленой химии для получения ряда наночастиц металлов (Ag, Au, Pt, Pd) и оксидов металлов (CuO) с использованием водных растворов природного полимера GK. Биологический эффект этих вновь полученных НЧ был исследован на C. Reinhardtii используя ряд клеточных ответов, включая рост водорослей, окислительный стресс, повреждение мембран, Chl флуоресценция и фотосинтез. Стабильность, размер и дзета-потенциал НЧ определяли в среде для выращивания водорослей, а также определяли растворимость и абиотические тесты образования АФК.
Методы
Материалы
Технический ГК, нитрат серебра (AgNO 3 ), тетрахлораурат водорода (HAuCl 4 · 3H 2 O), хлорид меди (CuCl 2 · 2H 2 O), платинохлористоводородная кислота (H 2 PtCl 6 ), тетрахлорпалладат (II) калия (K 2 PdCl 4 ), хлористый водород (HCl), гидроксид натрия (NaOH) и гидроксид аммония (NH 4 OH) все были приобретены в Sigma-Aldrich, США. Во всех экспериментах использовалась деионизированная (ДИ) вода. Все химические вещества и реагенты, использованные в этом исследовании, были аналитической чистоты.
C. Reinhardtii культура водорослей (штамм CPCC11) была получена из Канадского центра психологических культур (CPCC, Департамент биологии, Университет Ватерлоо, Канада).
Обработка GK
Порошок GK (1 г) помещали в стеклянный стакан, содержащий 1 л деионизированной воды, и осторожно перемешивали в течение ночи на магнитной мешалке. Затем раствор жевательной резинки оставляли при комнатной температуре (20 ° C) на 18 часов для отделения нерастворенных веществ. Затем раствор жевательной резинки фильтровали через воронку из пористого стекла (размер пор 10–16 мкм), а прозрачный раствор лиофилизировали и хранили до тех пор, пока он не понадобился.
Синтез металлов и наночастиц оксидов металлов с использованием GK
Вкратце, аликвоты по 100 мкл 10 мМ AgNO 3 , HAuCl 4 , H 2 PtCl 6 и K 2 PdCl 4 растворы добавляли к 10 мл водного раствора ГК в отдельных конических колбах на 50 мл. PH коллоидной дисперсии регулировали добавлением 0,1 н. HCl или 0,1 н. NaOH для достижения максимального выхода образования НЧ. Чтобы синтезировать НЧ Ag, Au, Pt и Pd, AgNO 3 , HAuCl 4 , H 2 PtCl 6 , и K 2 PdCl 4 и смеси ГК перемешивали в орбитальном шейкере Innova 43 (New Brunswick Scientific, США) при 250 об / мин при температурах от 45 до 95 ° C в течение 1 ч. Растворы стали светло-желтыми, винно-красными, интенсивно-черными и приглушенно-черными, соответственно, что указывает на образование НЧ Ag, Au, Pt и Pd. В случае Pt восстановление и образование НЧ происходило при pH 8,0 и температуре 90 ° C, в то время как НЧ Pd формировались при pH 8,5 и 95 ° C. См. Больше в Padil et al. [66, 67].
НЧ CuO были синтезированы методом коллоидного термического синтеза [13]. Вкратце, аликвоты по 100 мкл 10 мМ раствора дигидрата хлорида меди (CuCl 2 · 2H 2 О) смешивали с 10 мл раствора ГК (100 мг, диспергированного в 10 мл деионизированной воды) и NaOH в отдельных конических колбах на 50 мл с CuCl 2 · 2H 2 О и NaOH поддерживали в молярном соотношении 2:5. Смесь, содержащая CuCl 2 · 2H 2 О и GK перемешивали при 250 об / мин при температуре 75 ° C в течение 1 ч в орбитальном шейкере. Цвет смеси постепенно менялся от голубоватого до черного, что свидетельствовало об образовании НЧ CuO. Полученный осадок получали центрифугированием и промывали сначала этанолом, затем деионизированной водой.
Характеристика НЧ, синтезированных зеленым веществом
Концентрацию металла в свежесинтезированных НЧ измеряли с помощью масс-спектрометрии с индуктивно связанной плазмой (ICP-MS, OPTIMA 2100 DV, Perkin Elmer).
Образование и стабильность металлических наночастиц оценивали с помощью спектрофотометра Cintra 202 UV-Vis (GBC, Австралия), стабильность наночастиц определяли через 6 месяцев.
Изображения НЧ Ag, Au, Pt, Pd и CuO с помощью просвечивающей электронной микроскопии (ПЭМ) получали с использованием микроскопа Tecnai F 12 (FEI, Thermo Fisher Scientific, Орегон, США), работающего при ускоряющем напряжении 15 кВ. Образцы для ПЭМ-анализа готовили путем капания 10–20 мкл дисперсии ГК-неорганических НЧ на медную сетку и сушки при комнатной температуре после удаления избытка раствора.
Условия культивирования водорослей
Chlamydomonas reinhardtii культивировали в среде TAPx4 (дополнительный файл 1:таблица S1, дополнительная информация) при 20 ° C в инкубаторе (Infors, Швейцария), оборудованном встряхивателем, непрерывно вращающимся со скоростью 100 об / мин, и режимом освещения 114,2 мкмоль фот m - 2 s −1 . Клетки водорослей росли с экспоненциальной скоростью, чтобы получить примерно 10 6 клеток / мл.
Характеристика НЧ в среде воздействия водорослей
Распределение NP по размерам в C. Reinhardtii Среду TAPx4 измеряли методом дифференциальной центробежной седиментации (DCS) на дисковой центрифуге DC24000UHR (CPS Instruments Inc., США). Измерения проводились при скорости вращения диска 24000 об / мин, осаждение частиц проводилось с использованием 8–24% ( w / w ) градиент плотности сахарозы. Перед каждым измерением образца прибор калибровали с использованием стандартов наносфер ПВХ (470 нм). НЧ также характеризовались электрофоретической подвижностью, и приближение Смолуховского использовалось для определения дзета-потенциала (ZP) на Zetasizer ZS (Malvern Instruments Ltd., Великобритания). Каждое измерение проводилось в течение 10 прогонов с автокорреляционными функциями по 10 с, каждый результат был получен из трех измерений одного и того же образца.
Метод ультрафильтрации использовался для определения количества иона металла в водорослевой среде (Cheloni et al. [47]; Ma et al. [68]). Аликвоты, отобранные через разные интервалы времени (2 и 24 ч), центрифугировали в течение 30 мин при 7500 об / мин для разделения частиц и агрегатов. Затем супернатант фильтровали через ультрафильтрационные фильтры Amicon Ultracel 3K с отсечкой по молекулярной массе 3 кДа (Millipore, США) для отделения ионов от частиц. НЧ и агрегаты диаметром более 1,3 нм задерживались на фильтре, а фильтрат анализировался методом ICP-MS на содержание растворенных ионов [68].
Генерацию абиотических АФК при увеличении концентрации НЧ в водорослевой среде определяли с использованием флуоресцентного диацетата дихлородигидрофлуресцеина (H 2 DCF-DA, Sigma – Aldrich, Швейцария), как описано в более ранних исследованиях [47, 69].
Влияние НЧ на рост водорослей, целостность мембраны и создание окислительного стресса
Влияние НЧ металлов и оксидов металлов на рост водорослей, целостность мембран и возникновение окислительного стресса было протестировано с помощью проточной цитометрии (FCM; BD Accuri C6 Flow Cytometer, BD Biosciences, США). Эксперимент проводили в прозрачных флаконах (PS, 50 мл, Semadeni, Швейцария), содержащих 5 мл суспензии водорослей и НЧ в концентрациях 1, 5, 10 и 20 мг / л. Параллельно запускали контрольные образцы без НЧ. Клетки водорослей нагревали в кипящей воде (100 ° C) в течение 15 мин, чтобы обеспечить положительный контроль поврежденных клеточных мембран. Клетки водорослей также обрабатывали тмином (Sigma-Aldrich, США), агентом окислительных видов, в течение 30 минут в темноте в качестве положительного контроля окислительного стресса (ROS). Все необработанные образцы и образцы, обработанные НЧ, инкубировали в условиях, аналогичных условиям, принятым для поддержания культур. Части образцов были взяты через 1, 3, 5 и 24 ч для оценки влияния НЧ на целостность клеточной мембраны и окислительный стресс с использованием FCM. Аликвоту 250 мкл каждого образца переносили в 96-луночный планшет Microtiter® с плоским дном. Для оценки целостности клеточной мембраны к образцу добавляли флуоресцентные зонды пропидия иодида (PI) (P4170, Sigma-Aldrich, США) до конечной концентрации 7 мкМ. Для обнаружения окислительного стресса к образцам добавляли реагент CellROX® Green (ROS) (C10444, Life Technologies, США) в соответствии с инструкциями по продукту. Короче говоря, PI связывается с ДНК и присоединяется к РНК после внутриклеточного проникновения через поврежденные клеточные мембраны, но исключается из здоровых клеток. CellROX® Green Reagent - это зонд для измерения окислительного стресса в живых клетках. Проникающий в клетки краситель слабо флуоресцирует в восстановленном состоянии, но проявляет ярко-зеленую фотостабильную флуоресценцию при окислении АФК и последующем связывании с ДНК. Таким образом, его сигнал в первую очередь локализован в ядре и митохондриях. Планшеты инкубировали в темноте в течение 20 минут (PI) и 30 минут (ROS) перед измерением FCM. Затем суспензии водорослей пропускали через FCM с помощью голубого возбуждающего лазера с длиной волны 488 нм. CellROX Green измеряли в канале FL1 533/30 нм, красную флуоресценцию PI в канале FL2 585/40 нм и красную автофлуоресценцию хлорофилла а ( Chla ) в канале FL3> 670 нм. Эксперимент проводили в двух экземплярах и повторяли.
Данные FCM анализировали с помощью программы CFlow Plus (BD Biosciences, США). Образцы были заблокированы на основании свойств прямого рассеяния и красной автофлуоресценции Chla , для устранения сигналов от ЯЧ, мусора и других загрязняющих веществ. Количество клеток, процент поврежденных клеточных мембран или клеток с окислительным стрессом, а также данные автофлуоресценции были получены на основе автофлуоресценции Chla (670 нм), PI-меченые клетки (585 нм) и ROS Green (533 нм) (дополнительный файл 1:Рисунок S1).
Эффективность Algal Photosystem II
Суспензии НЧ металлов и оксидов металлов добавляли к той же культуре водорослей (примерно 10 6 клеток / мл) в стеклянных колбах на 15 мл для достижения конечных концентраций 1, 5, 10 и 20 мг / л. В качестве отрицательного контроля готовили культуры водорослей без НЧ. Затем все образцы были перенесены в инкубатор в тех же условиях, что и исходные культуры водорослей. Аликвоты (2,2 мл) каждого образца отбирали сразу и через 1, 3, 5 и 24 ч инкубации для определения квантового выхода фотосистемы II (QY) с использованием флуориметра AquaPen-C AP-C 100 (PSI Ltd., Чехия). Республика). Все измерения проводились в трех экземплярах. QY представляет собой коэффициент переменной флуоресценции ( F v = F м - F 0 ) до максимальной флуоресценции ( F м ), где QY = F v : F м используется в качестве показателя эффективности фотохимического тушения [70]. F м был получен путем применения освещения с длиной волны 680 нм в течение нескольких секунд до и в конце освещения с минимальной флуоресценцией ( F 0 ) является начальным измерением при минимальном уровне флуоресценции в отсутствие фотосинтетического света.
Статистический анализ
Влияние наночастиц металлов и оксидов металлов на C. Reinhardtii были протестированы с использованием дисперсионного анализа ANOVA и критерия Даннета (GraphPad PRISM, США). Уровни значимости были установлены на уровне * P <0,05, ** P <0,01 и *** P <0,001.
Результаты
Формирование и первичная характеристика НП
ПЭМ-изображения наночастиц Ag, Au, Pt, Pd и CuO, синтезированных с использованием GK, показывают хорошо разделенные сферические наночастицы диаметром от 2 до 100 нм (рис. 1a – e). Водные растворы коллоидных наночастиц, исследованные с помощью УФ-видимой спектроскопии (рис. 1f), показали отчетливый поверхностный плазмонный резонанс при 412 и 525 нм, что согласуется с образованием наночастиц Au и Ag внутри сети GK. Для НЧ Pt, Pd или CuO отчетливых поверхностных плазмонных резонансов не наблюдалось. Измерения в УФ-видимом диапазоне через 6 месяцев подтвердили стабильность всех НЧ, причем в спектрах был обнаружен единственный пик с таким же средним размером, что и у свежеосинтезированных НЧ (дополнительный файл 1:Рисунок S2).
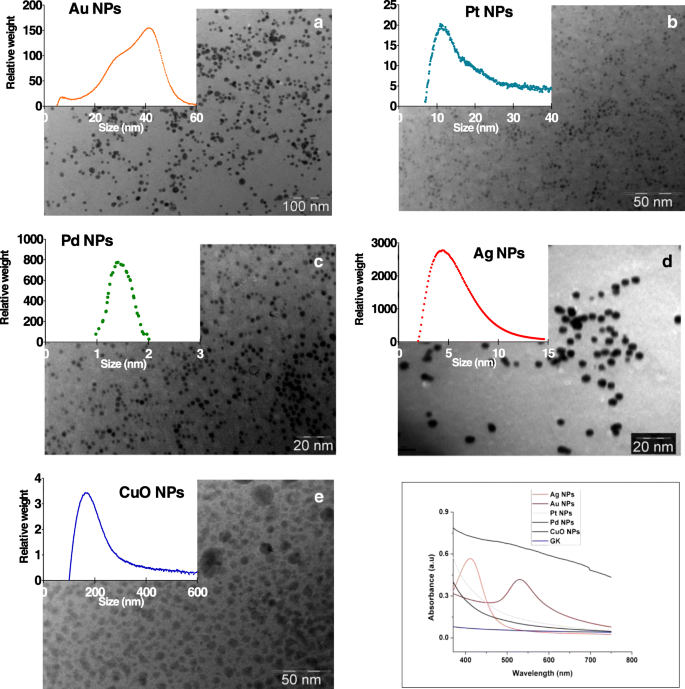
Изображения a , полученные с помощью просвечивающей электронной микроскопии Au, b Pt, c Ag, d Pd и e Наночастицы CuO синтезированы с использованием камеди карайи и их соответствующих солей металлов. а , b , c , d и е на вставках графиков показано распределение пиков по размеру частиц по массе наночастиц в водорослевой среде, определенное дифференциальным центробежным осаждением. (F) УФ – видимые спектры наночастиц Au, Ag, Pt, Pd и CuO
Характеристика НЧ в среде воздействия водорослей
Размер НЧ, в зависимости от распределения по массе, составлял от 180 до 5 нм следующим образом:CuO> Au> Pt> Ag> Pd. Все НЧ были отрицательно заряжены при pH 7 (таблица 1 и дополнительный файл 1:рисунок S3). НЧ Pt, Ag и CuO имеют самые высокие концентрации ионов металлов (33–36 мкг / л), а НЧ Au и Pt - самые низкие (6–7 мкг / л) (Таблица 1). Ионные формы металлов обнаружены в водорослевой среде (таблица 1).
Влияние на рост водорослей
Незатронутый C. Reinhardtii культура имела скорость роста 1 × 10 6 клеток / ч. В присутствии 1 мг / л НЧ Ag, Pd и CuO скорость роста резко снизилась до 2,2 × 10 4 , 1,7 × 10 4 и 0,2 × 10 4 ячеек / ч соответственно ( P <0,001). При дальнейшем увеличении концентрации NP рост водорослей полностью подавлялся (рис. 2). Когда водоросли подвергались воздействию НЧ Au и Pt, скорость роста также значительно снижалась по сравнению с контролем ( P <0,001), но повышение концентрации не усиливало эффекта.
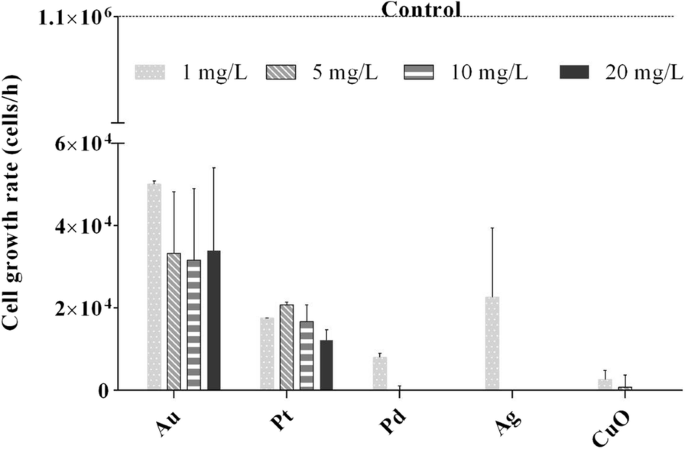
Скорость роста Chlamydomonas reinhardtii подвергается воздействию наночастиц металлов и оксидов металлов Au, Pt, Pd, Ag и CuO (1, 5, 10 и 20 мг / л). Скорость роста для необлученного контроля (культура водорослей) составляла 1 × 10 6 клеток / час через 24 часа. Планки погрешностей представляют собой стандартное отклонение повторных экспериментов с использованием повторяющихся образцов
Генерация окислительного стресса в клетках
Окислительный стресс варьировал в зависимости от типа НЧ (рис. 3). Наибольший эффект, почти 100% пораженных клеток, был вызван 5–20 мг / л НЧ Ag и CuO (Рис. 3d, e и Дополнительный файл 1:Таблица S2). Когда клетки водорослей подвергались действию НЧ Au, окислительный стресс был намного ниже, в основном затрагивалось <10% клеток. Самые высокие концентрации НЧ Au (20 мг / л) затронули только 15% клеток ( P <0,001). Процент подверженных стрессу клеток постепенно снижался с течением времени, при этом окислительный стресс не обнаруживался через 24 часа для всех исследованных концентраций Au (рис. 3а). НЧ Pt вызывали окислительный стресс менее чем в 8% клеток водорослей в течение первых 5 часов воздействия (рис. 3б). Только при концентрациях 10 и 20 мг / л стресс генерировался в 10 и 19% клеток, соответственно, через 24 часа ( P <0,001; Дополнительный файл 1:Таблица S2), при более низких концентрациях напряжение не обнаружено ( P > 0,1) через 24 ч воздействия (рис. 3б). Воздействие 1 мг / л НЧ Ag не вызывало окислительного стресса в клетках водорослей в течение 24 часов ( P > 0,9). Однако воздействие 5 мг / л приводило к окислительному стрессу через 5 часов, а воздействие 10 и 20 мг / л приводило к окислительному стрессу через 3 часа. После 24-часового воздействия НЧ Ag 100% клеток подверглись стрессу ( P <0,001; Рис. 3c и Дополнительный файл 1:Таблица S2). НЧ CuO индуцировали значительное ( P <0,001) окислительный стресс в клетках водорослей быстрее (3 часа), чем другие металлические НЧ, испытанные при 10 и 20 мг / л (дополнительный файл 1:Таблица S2), за исключением НЧ Ag. Окислительный стресс уже был значительным при 5 мг / л через 5 часов. Все концентрации (> 5 мг / л) оказали значительное влияние на окислительный стресс клеток (рис. 3d, e). В качестве дополнительного параметра мы также определили абиотические АФК, генерируемые НЧ. В отличие от C. Reinhardtii скорость роста и процент C. Reinhardtii В клетках, проявляющих окислительный стресс, НЧ Au генерировали лишь небольшое увеличение абиотических АФК ( P > 0,05; Дополнительный файл 1:Рисунок S4).
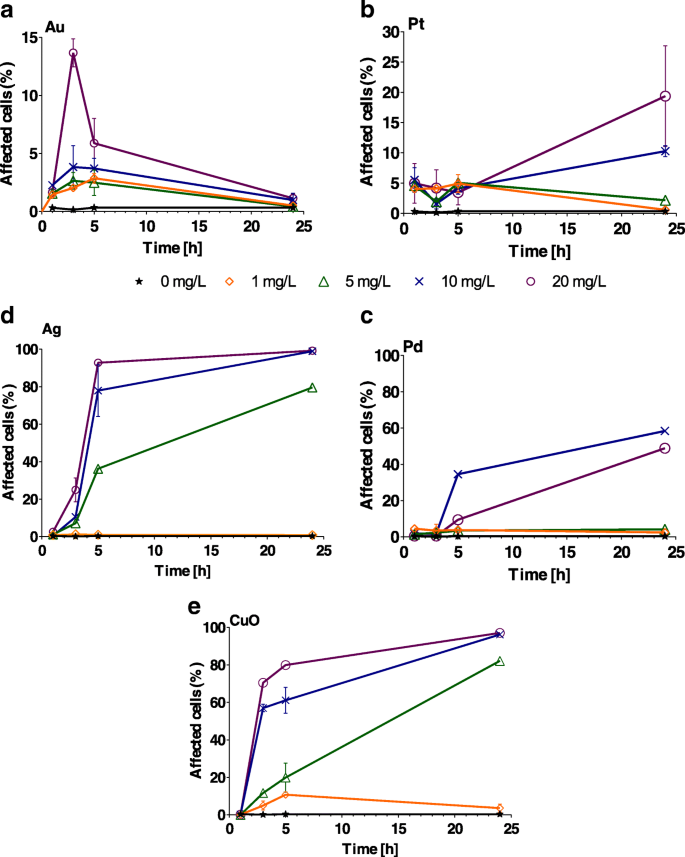
Процент Chlamydomonas reinhardtii клетки, проявляющие окислительный стресс после воздействия возрастающих концентраций (1, 5, 10 и 20 мг / л) a Au, b Pt, c Pd, d Ag и e Наночастицы CuO через 1, 3, 5 и 24 ч. Планки погрешностей представляют собой стандартное отклонение повторных экспериментов с использованием повторяющихся образцов. Обратите внимание на разные y шкалы осей для Au и Pt
Влияние на целостность мембраны водорослей
НЧ Au и Pt вызвали значительное ( P <0,001) повреждение клеточной мембраны при всех концентрациях от 1 до 5 ч (дополнительный файл 1:таблица S3); однако никакого значительного эффекта ( P > 0,05) наблюдали через 24 ч (рис. 4а, б). В случае НЧ Ag были повреждены 100% клеток ( P <0,001) через 1 час воздействия 1–20 мг / л (рис. 4c, дополнительный файл 1:таблица S3, Ag). Процент клеточных мембран, поврежденных после воздействия НЧ Pd 1 и 5 мг / л (дополнительный файл 1:Таблица S3, Pd), был сопоставим с таковым для контроля в течение 24 часов ( P > 0,4). С другой стороны, значительный ущерб ( P <0,001) наблюдали через 24 ч воздействия НЧ Pd с концентрацией 20 мг / л (рис. 4d). Эффект CuO усиливается с увеличением концентрации и времени, достигая максимального эффекта через 24 часа (рис. 4e и дополнительный файл 1:таблица S3).
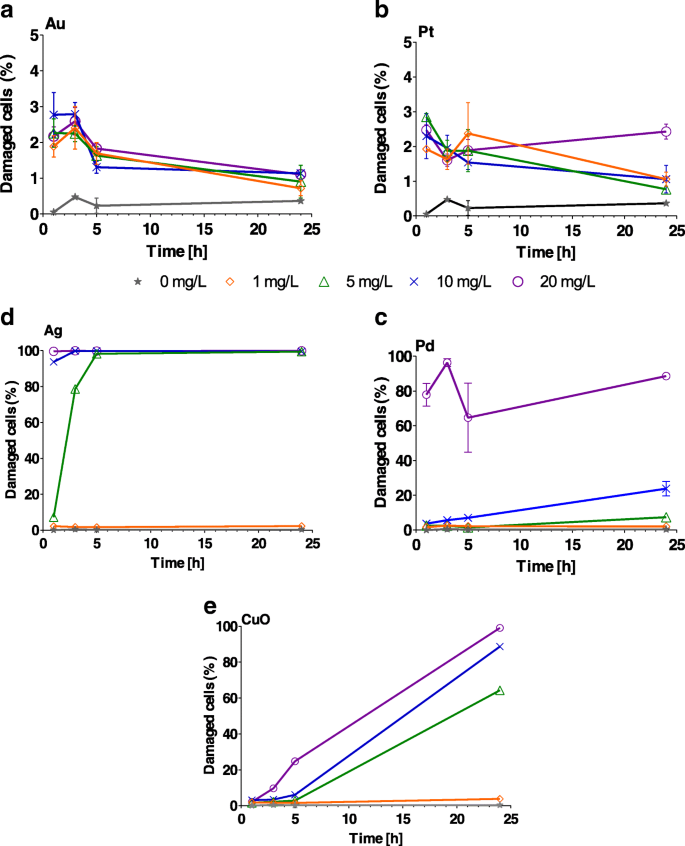
Процент Chlamydomonas reinhardtii клетки с поврежденными мембранами после воздействия возрастающих концентраций (1, 5, 10 и 20 мг / л) a Au, b Pt, c Pd, d Ag и e Наночастицы CuO через 1, 3, 5 и 24 ч. Планки погрешностей представляют собой стандартное отклонение повторных экспериментов с использованием повторяющихся образцов. Обратите внимание на разные y шкалы осей для Au и Pt
Влияние на хлорофилл ( Chl ) Флуоресценция
Chl флуоресценция существенно не изменилась ( P > 0,1) НЧ Au при любой концентрации в течение 24-часового периода и Pt в течение 5-часового периода (Рис. 5a, b и Дополнительный файл 1:Таблица S4). С другой стороны, НЧ Ag, Pd и CuO сильно ингибируют ( P <0,001) Chl флуоресценция с увеличением концентрации и времени экспозиции, например Chl флуоресценция снизилась с 98% (1 час) до 22% (24 часа) ( P <0,001), когда клетки водорослей выращивали в присутствии 5 мг / л Ag (дополнительный файл 1:таблица S4). Аналогичное снижение флуоресценции наблюдалось также для 10 и 20 мг / л Ag, при этом уровни упали до 20 и 9% ( P <0,001) соответственно (рис. 5в). НЧ CuO и Pd (оба по 20 мг / л) вызвали резкое снижение содержания Chl флуоресценция через 24 часа ( P <0,001). Наблюдаемого эффекта не было ( P > 0,1), однако для 1 или 5 мг / л Pd и для 1 мг / л НЧ Ag и CuO (рис. 5c – e).
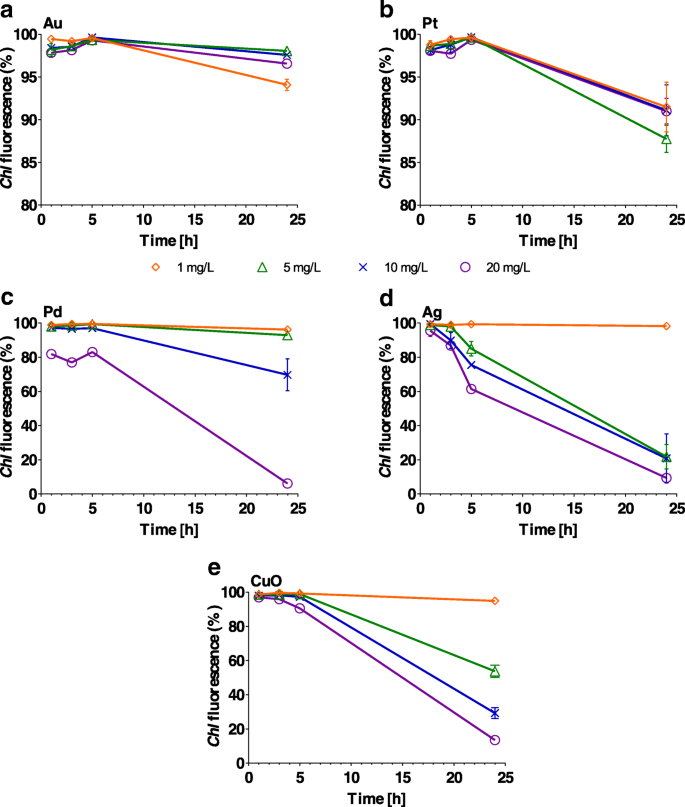
Процент Chlamydomonas reinhardtii клетки с хлорофиллом ( Chl ) флуоресценции после воздействия возрастающих концентраций (1, 5, 10 и 20 мг / л) a Au, b Pt, c Pd, d Ag и e Наночастицы CuO через 1, 3, 5 и 24 ч. Планки погрешностей представляют собой стандартное отклонение повторных экспериментов с использованием повторяющихся образцов
Влияние НЧ на фотосистему водорослей II
НЧ Au, Pt и CuO оказали незначительное влияние ( P <0,05) в фотосистеме II QY в некоторые моменты времени в течение 24-часового периода при концентрациях от 1 до 20 мг / л (рис. 6 и дополнительный файл 1:таблица S5). С другой стороны, QY значительно сократился ( P <0,001) уже через 1 час после контакта с НЧ Ag при всех концентрациях (рис. 6c и дополнительный файл 1:таблица S5). НЧ Pd и CuO привели к значительному снижению QY при максимальной концентрации 20 мг / л (рис. 6d, e и дополнительный файл 1:таблица S5).
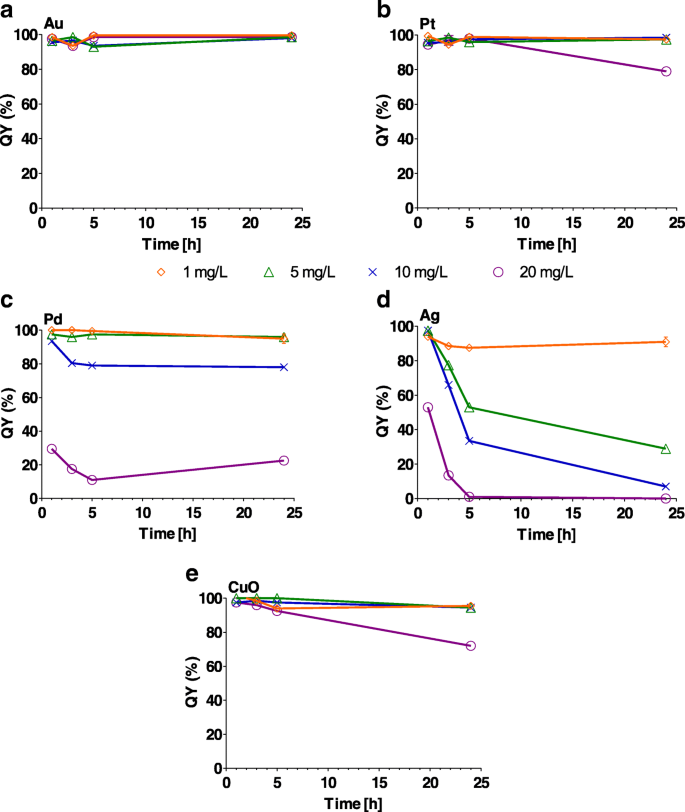
Эффект а Au, b Pt, c Pd, d Ag и e Наночастицы CuO (1, 5, 10 и 20 мг / л) на эффективность фотосистемы II (QY%) через 1, 3, 5 и 24 часа. Сто процентов на y -axis представляет собой QY контрольной культуры водорослей без наночастиц. Планки погрешностей представляют собой стандартное отклонение повторных экспериментов с дублированными образцами
Обсуждение
В настоящей работе мы стремились изучить устранение образования токсичных отходов при синтезе металлов и наноматериалов оксидов металлов при реализации подхода зеленой химии [16, 57, 58], при этом основной упор был сделан на использование экологически безопасных диспергаторов и возобновляемые и биоразлагаемые материалы. Мы успешно использовали GK, натуральный, возобновляемый и биоразлагаемый материал для синтеза и стабилизации ряда НЧ. При использовании деионизированной воды в качестве растворителя функциональные группы, присутствующие в GK (т.е. –OH и –COO–), действовали как восстанавливающие агенты, а сам GK-полимер действовал как блокирующий агент для образованных НЧ, тем самым обеспечивая зеленый синтез НЧ [59, 68]. НЧ, синтезированные в нашем исследовании (Au, Pt, Pd, Ag и CuO), были сопоставимы по размеру, стабильности и рентабельности с другими НЧ, синтезированными в зеленых тонах из предыдущих исследований [13, 69].
Затем мы использовали диапазон наноразмерных концентраций (1–20 мг / л), связанных с ожидаемыми или зарегистрированными концентрациями в окружающей среде [39, 71,72,73], чтобы оценить биологический эффект НЧ на C. Reinhardtii используя такие конечные точки, как рост водорослей, целостность мембран, Chl эффективность флуоресценции фотосистемы II и окислительный стресс. Наши результаты выявили две отдельные группы:НЧ Au и Pt, оказывающие незначительное влияние на водоросли или не влияющие вовсе, и НЧ Ag, Pd и CuO, проявляющие сильное влияние почти на все конечные точки (Дополнительный файл 1:Таблица S6). Исследования токсичности НЧ металлов или оксидов металлов выявили несколько ключевых физико-химических характеристик НЧ, которые могут быть связаны с их токсичностью, включая состав, покрытие, размер, форму и гомо- или гетероагрегацию [69, 74,75,76,77, 78]. Более того, токсичность растворенного металла (ионной формы) ранее была продемонстрирована на водорослях с использованием ряда критериев, включая образование внутриклеточных АФК, Chl истощение и ингибирование фотосинтеза [79,80,81]. Мы четко обнаружили образование АФК и их влияние на рост, Chl производство и фотосистема II после воздействия НЧ Ag, Pd и CuO.
Хотя НЧ Pd обычно считались токсичной группой, они не были широко изучены, и только недавно они были признаны важными антибактериальными НЧ [41]. Обычно считается, что малый размер (1,5–3 нм) НЧ Pd способствует их антибактериальным свойствам, возможно, облегчая транспортировку к клеткам через поры клеточной стенки бактерий или водорослей, диаметр которых составляет от 5 до 20 нм [82, 83] . В нашем исследовании НЧ Pd со средним размером 1,5 нм могли напрямую проникать в стенки клеток водорослей и вызывать повреждение при высвобождении ионов в клеточной мембране и хлоропластах ( Chl fluorescence, PS II, ROS). There is clear evidence that soluble Pd salt was able to enter P. subcapitata cells, where Pd precipitates were mostly formed in chloroplasts [78] which could increase generation of ROS and thus oxidative stress. It was also reported that Pd NPs (127 nm z -average hydrodynamic size) were less toxic toward P. subcapitata than soluble Pd salt [69] maybe due to larger size of NPs that could not directly enter the cells, while Pd salt could. On the other hand, Pd NPs could form hetero-aggregates with algal cells leading to physical entrapment. Surprisingly, the entrapment is not inevitably lethal because the cells could recover their growth after transfer to clean medium [69].
Numerous studies have shown that Ag NPs toxicity to algae was mainly driven by Ag ions dissolved in the exposure medium rather than Ag NPs and also depended on Ag NPs coatings and sizes [80, 84,85,86,87,88,89]. Our study revealed high toxicity of Ag NPs thus suitable for algicidal applications. The ionic Ag and/or Ag NPs (5 nm) could directly enter algal cells [90], causing damage to the cell membranes and other cellular compartments by ROS formation. Moreover, Ag NPs could damage algal cells by direct interaction between NPs and algal cells [72] or the type of NPs coating could play a significant role. For example, dexpanthenol, polyethylene glycol and polyvinyl polypyrrolidone coatings caused a similar effect as AgNO3 on C. reinhardtii , while carbonate, chitosan, and citrate decreased the Ag effect on photosynthesis [87]. Our Ag NPs showed strong effect toward C. reinhardtii regardless GK coating.
The ecotoxicity of CuO NPs has been extensively studied [36, 47,48,49, 69, 91]. We observed CuO NPs harming cell membranes right after 1 h, while the ROS elevated after 3 h at concentrations higher than 5 mg/L and also Chl fluorescence substantially decreased over 24 h. It is possible that the CuO NPs (or ionic Cu)-damaged membranes could increase further uptake of Cu and oxidative stress in the C. reinhardtii cells [91] where observed hetero-aggregation of NPs and the cells (data not shown) could even enhance this interaction. von Moos et al. [36] stated that free Cu 2+ or the NPs themselves were the main mediators of toxicity toward C. reinhardtii , while Cheloni et al. [47] believed ion Cu at lower CuO NPs concentrations was the driving force, being unable to clarify the contribution of dissolved Cu in CuO NPs . This was probably elucidated by other study revealed much stronger effect of soluble ionic Cu and soluble fraction of CuO NPs on P. subcapitata than bare CuO NPs [69].
Au NPs slightly increased membrane impairment and oxidative stress after 3 and 5 h, but these effects disappeared after 24 h. Interestingly, abiotic ROS were constantly generated during whole 24 h study contrary to all other NPs. We assume that stable conditions allowed the cells to cope with such small level of stress. Previous study has reported a range of EC50 values for dissolved Au on C. reinhardtii of between 5.9 and 1.7 mg/L, depending on exposure time [92]. In our opinion, almost any Au NP toxicity would not have been exacerbated or affected by the degree of ion Au and would have had nearly no bearing on any of the criteria adopted for our experiments. Moreover, Au NPs seemed to be well dispersed in exposure media and we did not observe any aggregates or direct interactions with the C. reinhardtii cells (data not shown).
We found that Pt NPs caused slight Chl and a growth rate decrease after 24 h for all concentrations. These not so pronounced effects could be caused by both ionic Pt and Pt NPs. Up to now, there has been only limited knowledge about the toxicity of Pt NPs on algae. For example, Pt NPs decreased growth rate, and Chl fluorescence and oxidative stress on P. subcapitata and C. reinhardtii [39, 40]. The latter authors also suggested that the toxicity of Pt NPs might be only partly attributed to dissolved form of Pt in the case of P. subcapitata and that also the shading effect might influence toxicity [40]. In our study, we did not find such evidence.
Conclusions
Green-synthesised metal and metal oxide NPs were produced at nanoscale sizes of 42 nm (Au), 12 nm (Pt), 1.5 nm (Pd), 5 nm (Ag) and 180 nm (CuO):all with a negative charge. GK, a natural hydrocolloid, was successfully applied as a safe, cost-effective stabiliser and showed no aggregation (all NPs) after 6 months at + 4 °C. The biological effect (algal growth, membrane integrity, oxidative stress, Chl fluorescence and photosystem II efficiency) of these NPs was investigated on green alga C. reinhardtii . All NPs had a significant effect on algal growth rate; however, Au and Pt NPs inhibited algal growth far less than the other NPs (Pd, Ag and CuO). In terms of other biological effects, Pd, Ag and CuO NPs caused significant cell membrane damage, highly affected Chl fluorescence and caused oxidative stress. Ag and Pd NPs mostly inhibited photosystem II, while it was not much affected by CuO (only the highest concentration of 20 mg/L significantly decreased QY) and Au or Pt. Generally, metal and metal oxide NPs were successfully synthesised following green chemistry rules, without harmful side-products and showing high stability. Some could find reasonable application in algicides (Ag and CuO) or antimicrobial surfaces (Pd, Ag and CuO), while Au and Pt proved to be almost non-toxic to green alga C. reinhardtii .
Наноматериалы
- Получение наночастиц mPEG-ICA, нагруженных ICA, и их применение в лечении LPS-индуцированного повреждения клеток H9c2…
- Биогенный синтез, характеристика и оценка антибактериального потенциала наночастиц оксида меди против Escheric…
- Влияние контактной неравновесной плазмы на структурные и магнитные свойства шпинелей Mn Х Fe3 - X О4
- Влияние различных связующих на электрохимические характеристики металлооксидного анода для литий-ионных ба…
- Синтез и эффективность in vitro покрытых полипирролом железо-платиновых наночастиц для фототермической терапии…
- Легкий синтез червоточиноподобного мезопористого оксида олова за счет самосборки, вызванной испарением, и у…
- Влияние метода синтеза наночастиц манганита La1 - xSr x MnO3 на их свойства
- Зеленая способность к синтезу и стабилизации наночастиц меди:каталитическая, антибактериальная, цитотоксич…
- Сапонины Platycodon из Platycodi Radix (Platycodon grandiflorum) для зеленого синтеза наночастиц золота и серебра
- Указатели и преграды на пути к зеленым цепочкам поставок



