Чувствительные к энзимам полые мезопористые наноплатформы кремнезема с блокированными хитозаном наноплатформы для доставки лекарств в толстую кишку
Аннотация
На основе полых мезопористых сфер кремнезема (HMSS), к которым биоразлагаемый хитозан (CS) был присоединен через расщепляемые азосвязи (HMSS – N =N – CS), была разработана ферментно-чувствительная система доставки, специфичная для толстой кишки. Доксорубицин (DOX) был инкапсулирован в некристаллическом состоянии в полой полости и мезопорах HMSS с высокой степенью загрузки 35,2%. Высвобождение лекарственного средства in vitro доказало, что HMSS – N =N – CS / DOX обеспечивает ферментативно-зависимое высвобождение лекарственного средства. Привитой CS может повысить биосовместимость и стабильность и снизить адсорбцию белка на HMSS. Результаты по раздражению слизистой оболочки желудочно-кишечного тракта и клеточной цитотоксичности показали хорошую биосовместимость HMSS и HMSS – N =N – CS. Результаты клеточного поглощения показали, что поглощение DOX явно увеличивалось после предварительной инкубации HMSS – N =N – CS / DOX со смесью ферментов толстой кишки. HMSS – N =N – CS / DOX, инкубированный с ферментами толстой кишки, показал повышенную цитотоксичность, а его IC 50 значение было в три раза ниже, чем у группы HMSS – N =N – CS / DOX без ферментов толстой кишки. Настоящая работа закладывает основу для последующих исследований мезопористых носителей для пероральной доставки лекарств, специфичных для толстой кишки.
Введение
В последнее время системы доставки лекарств, отвечающие на стимулы (DDS), привлекли большое внимание в связи с эффективной загрузкой и селективным высвобождением лекарств в пораженных тканях [1]. Разработанные системы, реагирующие на стимулы, могут доставляться в пораженные участки и обеспечивать высвобождение лекарств по требованию для улучшения терапевтических эффектов и предотвращения побочных эффектов, вызванных преждевременной утечкой. Все внутренние и внешние стимулы, такие как окислительно-восстановительный потенциал [2], pH [1], ферменты [3], температура и свет [4, 5], были использованы для создания DDS, реагирующих на стимулы. Среди этих стимулов, ферменты, как внутренние стимулы, привлекли большое внимание из-за их различной концентрации в разных тканях [6].
За последние два десятилетия мезопористые сферы диоксида кремния (MSS) с размером мезопор от 2 до 50 нм были признаны в качестве носителей лекарств, чувствительных к стимулам [7, 8], поскольку MSS имеют чрезвычайно большой объем пор и большую площадь поверхности для высокой способность загружать лекарственные средства, хорошо организованная структура пор, легко функционируемая поверхность и хорошая биосовместимость [9]. Кроме того, наночастицы с полыми мезопористыми сферами из диоксида кремния (HMSS) с мезопористой структурой оболочки и полой полостью превосходят обычные MSS, поскольку полая структура может эффективно удерживать больше лекарств с большей емкостью, чем носители MSS [10, 11]. Все виды реагирующих на стимулы наноносителей на основе MSS были разработаны для размещения молекул лекарств с использованием различных привратников, таких как полимеры [12], неорганические наночастицы [13], дендримеры, биомакромолекулы [14], макроциклические соединения, пептиды [15] и липиды [ 16]. Хотя многочисленные DDS, основанные на MSS с функциональным кэппированием, могут осуществлять высвобождение в ответ на различные внешние или внутренние стимулы, лишь немногие из них использовались для адресной доставки лекарств в толстую кишку.
Хорошо известно, что пероральная доставка лекарств - излюбленный и простой способ введения лекарств. Специфическая нацеленная доставка лекарств в толстую кишку очень удобна для лечения заболеваний толстой кишки, включая болезнь Крона, колоректальный рак и язвенный колит. Однако специфическая для толстой кишки доставка лекарств может столкнуться с рядом проблем, включая меньшее содержание воды и относительно меньшую поверхность для пероральной адсорбции, чем в других участках желудочно-кишечного тракта (ЖКТ) [17,18,19]. Кроме того, пероральные DDS также встречаются в сильной кислой среде в желудке, что может ускорять разложение загруженных лекарств в желудочно-кишечном тракте, тем самым лишая возможности осуществлять целенаправленную доставку в толстую кишку [19]. По этой причине было разработано несколько pH-зависимых DDS для реализации инициируемого pH высвобождения лекарств при почти нейтральных значениях pH (6-7) в желудочно-кишечном тракте, сопротивляясь высококислотным условиям в области желудка [20,21,22 , 23]. Существует лишь небольшая разница в кислотности между кишечной (pH 6,8) и толстой (pH 7,4) областями; следовательно, такие чувствительные к pH DDS затрудняют реализацию специфического для толстой кишки высвобождения.
Хитозан (CS), катионный и биоразлагаемый полисахарид, присутствующий в природе, состоит из β- (1-4) -связанных глюкозаминовых и N-ацетил-D-глюкозаминовых звеньев [24]. CS получил большое внимание в биологической медицине благодаря своим удивительным свойствам, включая биоразлагаемость, биосовместимость, мукоадгезивность и антибактериальную активность [25,26,27,28,29]. По сравнению с полимерами, полиэлектролитами и супрамолекулами, синтезируемыми с помощью сложных процессов, CS относительно дешев и легко доступен путем исчерпывающего деацетилирования хитина [30,31,32]. Кроме того, сообщалось, что CS может открывать плотные контакты между клетками, тем самым увеличивая абсорбцию лекарств [33]. Поэтому полимер CS был выбран в качестве кэпирующего агента из-за его хорошей биосовместимости и подходящего размера, чтобы покрывать мезопоры HMSS и блокировать высвобождение лекарства.
В нашей работе был впервые разработан специфичный для толстой кишки ферментно-чувствительный DDS на основе материала HMSS (HMSS – N =N – CS), как показано на схеме 1. В этой системе носители HMSS были приготовлены посредством селективного стратегия травления. Полимер CS был прикреплен к поверхности HMSS с помощью азосвязей, чтобы действовать как привратник, блокируя отверстия HMSS. Азосвязи между HMSS и CS могут расщепляться ферментами в сайтах толстой кишки [34, 35], что приводит к отделению CS от отверстий HMSS. DOX использовался в качестве модельного лекарственного средства для встраивания в полость HMSS, и были проведены эксперименты по высвобождению лекарственного средства in vitro для оценки ферментативного высвобождения в присутствии ферментов толстой кишки. Конфокальная лазерная сканирующая микроскопия (CLSM) и проточная цитометрия (FCM) были использованы для исследования клеточного поглощения клетками Caco-2. Наконец, была измерена цитотоксичность HMSS – N =N – CS / DOX по отношению к клеткам Caco-2.
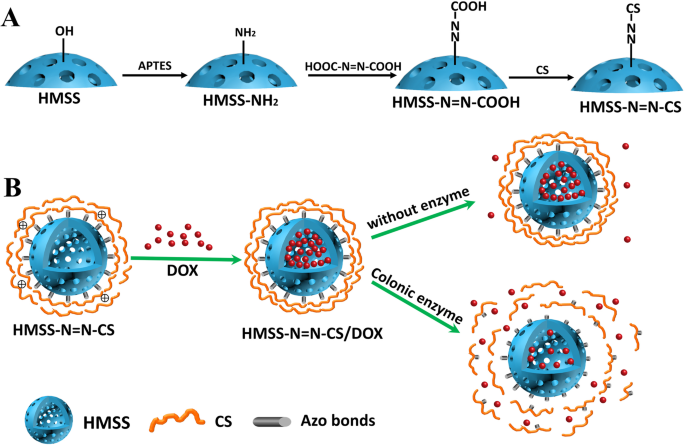
Схематическое изображение а процесс подготовки HMSS – N =N – CS и b загрузка лекарственного средства и ферментативное высвобождение HMSS – N =N – CS / DOX в ответ на фермент толстой кишки
Материалы и методы
Материалы
Тетраэтоксисилан (TEOS); Гидрохлорид N- (3-диметиламинопропил) -N-этилкарбодиимида (EDC); хитозан (DAC ≥ 95%); бромид цетилтриметиламмония (CTAB); 3-аминопропилтриэтоксисилан (APTES); 3- (4,5-диметилтиазол-2-ил) -2,5-дифенилтетразолий бромид (МТТ); азобензол-3,3'-дикарбоновая кислота; бромид калия (спектральная чистота ≥ 99,5%); N-гидроксисукцинимид (NHS) и DOX были приобретены у Aladdin Chemical Inc. (Шанхай, Китай). Азобензол-3,3'-дикарбоновая кислота была поставлена компанией Inno-chem Technology Co. Ltd. (Пекин, Китай). Среда для культивирования клеток DMEM, пенициллин-стрептомицин и фетальная бычья сыворотка (FBS) были предоставлены GIBCO, Invitrogen Co. (Карлсбад, США). Все аналитические реагенты не подвергались дополнительной очистке перед использованием.
Подготовка HMSS – N =N – CS
Подготовка HMSS – NH 2
Наночастицы HMSS были приготовлены на основе опубликованных работ с использованием метода селективного травления [36]. Твердые шарики кремнезема впервые были синтезированы модифицированным методом Штобера. Вкратце, 6 мл TEOS выливали в смесь 10 мл деионизированной воды, 74 мл этанола и 3 мл концентрированного NH 3 . · H 2 О. Затем смесь перемешивали в течение 60 мин для получения суспензий коллоидного диоксида кремния при температуре окружающей среды. Твердые сферы центрифугировали, промывали и сушили для дальнейшего использования. Затем мезопористую оболочку из диоксида кремния покрывали твердыми сферами из диоксида кремния. Триста миллиграммов твердого диоксида кремния диспергировали в 50 мл деионизированной воды с помощью ультразвуковой обработки в течение 45 минут. Суспензии диоксида кремния выливали в смесь 60 мл этанола, 450 мг CTAB, 90 мл воды и 1,7 мл NH 3 . · H 2 О. После перемешивания смеси в течение 60 минут добавляли TEOS (0,75 мл). Затем наночастицы центрифугировали после перемешивания в течение 6 часов для сбора образцов, а затем повторно диспергировали в 40 мл воды. Около 1,2 г Na 2 CO 3 добавляли в водную суспензию при интенсивном перемешивании. После выдерживания смеси при 55 ° C в течение 12 ч продукты наночастиц HMSS собирали и промывали безводным этанолом. Метод пост-прививки с соотношением HMSS и APTES 4:1 (м / об) для получения HMSS – NH 2 при 80 ° C под N 2 состояние в течение 8 ч, чтобы ЦТАБ был удален кипячением [3].
Подготовка HMSS – N =N – COOH
Азобензол-3,3'-дикарбоновую кислоту (50 мг) добавляли в PBS с pH 5,8. Затем добавляли (5 мг / мл) EDC и (3 мг / мл) NHS для активации азобензол-3,3'-дикарбоновой кислоты при 30 ° C в течение 1 часа. И 10 мл PBS, содержащего 15 мг / мл HMSS – NH 2 добавляли, и смесь перемешивали в течение 24 часов. И полученный HMSS – N =N – COOH отделяли центрифугированием и промывали этанолом.
Подготовка HMSS – N =N – CS
0,15 г CS и 0,5 мл уксусной кислоты добавляли в 50 мл воды для приготовления раствора CS. А 100 мг HMSS – N =N – COOH диспергировали в 25 мл PBS с pH 5,0 и активировали EDC и NHS в течение 0,5 часа. Затем в суспензию приливали раствор CS (10 мл) при непрерывном перемешивании в течение 1 суток. Наконец, синтезированный HMSS – N =N – CS был центрифугирован и промыт для сбора образцов.
Извлечение смеси ферментов толстой кишки из микрофлоры
Микрофлору толстой кишки собирали согласно опубликованной работе [37]. Затем культуру инокулировали для получения смеси ферментов, секретируемой микрофлорой толстой кишки, при 37 ° C. Смоделированную среду толстой кишки, содержащую смесь ферментов, фильтровали через фильтр 0,22 мкм для удаления всех клеточных остатков из культуральной жидкости. Впоследствии фильтрат лиофилизировали, чтобы получить смесь ферментов в виде порошка, которую использовали в дальнейшем исследовании.
Процесс загрузки лекарств и ферментно-чувствительный выпуск
Двадцать пять миллиграммов DOX растворяли в 5 мл раствора HCl с pH 3,5. И 100 мг HMSS – N =N – CS добавляли в раствор DOX и перемешивали при температуре окружающей среды в течение 12 часов. Затем использовали 0,2 М раствор NaOH, чтобы довести pH смеси до 7,0, и суспензию перемешивали еще 12 часов. Затем HMSS – N =N – CS, нагруженный DOX (называемый HMSS – N =N – CS / DOX), центрифугировали и промывали для удаления адсорбированного DOX на поверхности HMSS – N =N – CS. Супернатант собирали на каждом этапе для измерения эффективности загрузки DOX (LE) при 480 нм с помощью спектрофотометрии в УФ-видимом диапазоне. Общая масса DOX, загруженного в HMSS – N =N – CS, была рассчитана путем вычитания разгруженного DOX после процессов загрузки лекарственного средства из начальной массы добавленного DOX. HMSS / DOX получали в качестве контроля с использованием HMSS в качестве исходного носителя. УД DOX рассчитывали по формуле:
$$ \ mathrm {LE} \ \ left (\% \ right) =\ frac {m_A- {m} _B} {m_A- {m} _B + {m} _C} \ times 100 $$В котором м A была добавленная масса DOX, м B была масса DOX в супернатанте, и m C была полная масса HMSS – N =N – CS.
In vitro ферментативное высвобождение DOX из HMSS – N =N – CS / DOX оценивали следующим образом. Два миллиграмма наночастиц HMSS – N =N – CS / DOX и HMSS / DOX диспергировали в PBS с pH 7,4, встряхивая при 125 об / мин, с различными концентрациями смеси ферментов толстой кишки (0 мг / мл, 0,3 мг / мл и 1 мг / мл). . Через определенные интервалы времени отбирали 1 мл высвобождающей среды для измерения оптической плотности. Высвобождение DOX измеряли при 480 нм. HMSS / DOX использовался в качестве контроля.
Адсорбция BSA
Величину адсорбции БСА оценивали на основании опубликованных работ [38, 39]. BSA добавляли в PBS с pH 7,4 (0,5 мг / мл). Пять миллиграммов HMSS и HMSS – NH 2 и HMSS – N =N – CS добавляли в 2,5 мл PBS (pH 7,4). Подали равный объем раствора BSA, и суспензию поместили в шейкер со скоростью 100 об / мин. Через 6 ч центрифугирование использовали для сбора верхнего раствора. Наконец, после окрашивания раствором бриллиантового синего кумасси была измерена концентрация БСА при длине волны 595 нм.
Характеристика
Структуру мезопористой сетки и морфологию наночастиц HMSS оценивали с помощью изображений ПЭМ (EM – 208S, CSIS, США). Площадь поверхности и распределение пор по размерам наночастиц были охарактеризованы с использованием анализатора адсорбционного анализа азота (V-Sorb 2800P, Gold APP Instrument Corporation, Китай). Потенциалы ξ и размеры частиц были охарактеризованы на Nano-z90 Nanosizer (Malvern Instruments Ltd., Вустершир, Великобритания). Анализ ТГА проводили на приборе TGA-50 (Shimadzu, Киото, Япония) при скорости нагрева 10 ° C / мин в токе азота. Инфракрасные спектрофотометрические (FT-IR) спектры с преобразованием Фурье измеряли с использованием FT-IR спектрометра (Bruker Tensor27, Швейцария). Диапазон проводился от 400 до 4000 см −1 с использованием техники таблетирования KBr. Power XRD выполняли на рентгеновском дифрактометре Siemens D5005 (Карлсруэ, Германия) с Cu-Kα-излучением ( λ =1,5418 Å).
Эксперимент по культуре клеток и поглощению клеток
Клетки Caco-2 культивировали в среде с добавлением 10% FBS, 1% заменимых аминокислот, 1% (об. / Об.) Пировиноградной кислоты натрия и 1% стрептомицина. Клетки NIH-3T3 культивировали в DMEM с 1% стрептомицином и 10% FBS. Поглощение наноносителями клетками Caco-2 было охарактеризовано с использованием FCM и CLSM. Клетки Caco-2 высевали в 24-луночные планшеты. После культивирования в течение ночи в соответствующие лунки добавляли свободный DOX, HMSS – N =N – CS / DOX и HMSS – N =N – CS / DOX, предварительно инкубированные с наночастицами фермента толстой кишки (равной концентрации 5 мкг / мл DOX). . После продолжения инкубации в течение 2 ч клеточную среду удаляли и тщательно промывали PBS. Затем клетки фиксировали 4% формальдегидом и окрашивали Hoechst 33258 для наблюдения CLSM. FCM использовали для количественной оценки клеточного поглощения. Клетки Caco-2 высевали в 6-луночные планшеты и дополнительно инкубировали в течение 24 часов. После промывки PBS клетки Caco-2 инкубировали со свободным DOX, HMSS – N =N – CS / DOX и HMSS – N =N – CS / DOX, предварительно инкубированные с наночастицами фермента толстой кишки (равной концентрации 5 мкг / мл DOX) в бессывороточной среде DMEM в течение 2 часов. Затем клетки Caco-2 промывали холодным PBS, трипсинизировали и повторно суспендировали в 0,5 мл PBS. Флуоресценцию DOX в клетках измеряли с помощью проточного цитометра FACS Canto (Becton, Dickinson, США).
Анализ клеточной пролиферации in vitro
Цитотоксичность холостых носителей HMSS и HMSS – N =N – CS по отношению к клеткам NIH-3T3 и Caco – 2 подтверждена методом МТТ [40, 41]. Вкратце, клетки Caco – 2 и клетки NIH-3T3 отдельно высевали в 96-луночные планшеты и дополнительно инкубировали в течение ночи. Старая клеточная среда была заменена бессывороточной средой, содержащей различные концентрации наночастиц. После инкубации в течение 2 дней 50 мкл раствора МТТ (2 мг / мл –1 ) и инкубировали в течение 4 ч для измерения живых клеток. Затем раствор МТТ удаляли и добавляли 150 мкл ДМСО для растворения формазана. Затем оптическую плотность измеряли на считывающем устройстве для микропланшетов (Tecan, Männedorf, Швейцария) при 570 нм. Цитотоксичность свободного DOX, HMSS – N =N – CS / DOX и HMSS – N =N – CS / DOX, предварительно инкубированных со смесями ферментов, экстрагированных из микрофлоры толстой кишки, измеряли с использованием клеток Caco-2 с соответствующими концентрациями DOX (0,1, 1, 5, 10 и 20 мкг / мл). Время инкубации составляло 48 часов, а другие процессы эксперимента были такими же, как описано выше.
Исследования токсичности
Тесты на раздражение слизистой оболочки желудочно-кишечного тракта имеют жизненно важное значение для оценки биобезопасности пероральной доставки лекарств in vivo. Самцов крыс Sprague – Dawley (180 ± 10 г) случайным образом делили на три группы (по три крысы в каждой группе). Крысам вводили физиологический раствор, HMSS и наночастицы HMSS – N =N – CS в дозе 100 мг / кг каждый день. Через 7 дней всех крыс умерщвляли, ткани собирали и исследовали гистопатологическим исследованием (H&E). Для оценки биобезопасности HMSS и наночастиц HMSS – N =N – CS регистрировали массу тела мышей BALB / c (18–20 г) после перорального приема в дозе 100 мг / кг через день. Все экспериментальные процедуры были выполнены в соответствии с рекомендациями по уходу и использованию лабораторных животных Медицинского университета Цицикар и были одобрены этическим комитетом Цицикарского медицинского университета.
Статистика
Статистические данные были проанализированы с помощью программного обеспечения SPSS с использованием двухстороннего критерия Стьюдента t -контрольная работа. Планки погрешностей, представленные в этом исследовании, являются стандартными. А п <0,05 считается статистически значимым.
Результаты и обсуждение
Подготовка и определение характеристик HMSS – N =N – CS
HMSS были подготовлены на основе предыдущих работ с небольшими изменениями [36]. Во-первых, твердый SiO 2 Были приготовлены наносферы, и мезопористая оболочка была нанесена на поверхность твердых наносфер из диоксида кремния, содержащих шаблон CTAB. Затем Na 2 CO 3 был использован для селективного травления твердого SiO 2 наносферы, в то время как мезопористая оболочка была защищена шаблоном CTAB. Приготовление HMSS – N =N – CS с CS, присоединенным в качестве «привратника» с помощью азосцепления, описано на рис. 1a. Во-первых, поверхности наночастиц HMSS были модифицированы APTES в качестве реагента алкильного сочетания, чтобы стать амино-функционализированным HMSS (HMSS – NH 2 ) методом постмодификации. Впоследствии HMSS – N =N – COOH был получен реакцией амидирования между аминогруппами HMSS – NH 2 и карбоксильные группы азобензол-3,3'-дикарбоновой кислоты. Затем CS был ковалентно модифицирован на поверхности наночастиц HMSS путем реакции амидирования между карбоксильными группами HMSS – N =N – COOH и аминогруппами в CS.
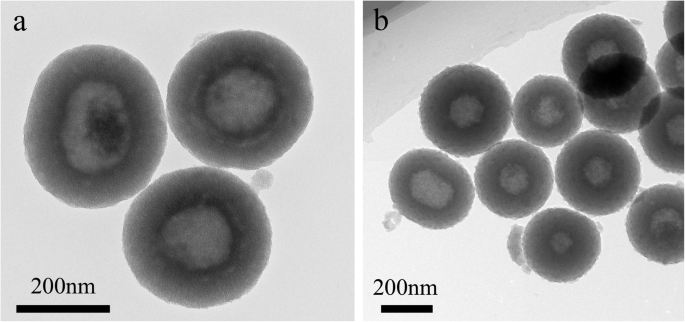
ТЕА из а HMSS и b HMSS – N =N – CS
Как показано на изображении просвечивающей электронной микроскопии (ПЭМ) на рис. 1а, средний диаметр HMSS составлял 280 нм, и HMSS имели однородную полую структуру и высокоупорядоченную мезопористую оболочку. Средняя толщина мезопористой оболочки составляла примерно 90 нм. По сравнению с гладкой поверхностью HMSS, поверхность привитого полимера HMSS – N =N – CS (рис. 1b) была шероховатой, что указывает на то, что CS покрывает носитель HMSS.
Площадь поверхности и распределение пор мезопористых материалов играют решающую роль в загрузке и доставке молекул-хозяев для контролируемого высвобождения. Кривые и изотермы распределения пор по размерам измеряли с помощью N 2 адсорбционно-десорбционный анализ (рис. 2). Подробные параметры (площадь поверхности Брунауэра – Эммета – Теллера (БЭТ) ( S ) СТАВКА ), общий объем пор ( V P ) и распределение пор по размерам ( D P )) отображаются в таблице 1. Значки S СТАВКА и V P чистой HMSS составили 810,7 м 2 / г и 0,969 см 3 / g соответственно, а D P составляла примерно 3,8 нм. D P компании HMSS – NH 2 был почти таким же, как у HMSS после аминирования, что указывает на то, что мезопоры не были заблокированы после функционализации аминогруппы. S СТАВКА и V P HMSS – N =N – CS заметно уменьшились после модификации азосоединением и покрытием CS, что указывает на то, что CS покрыл поверхность HMSS [1].
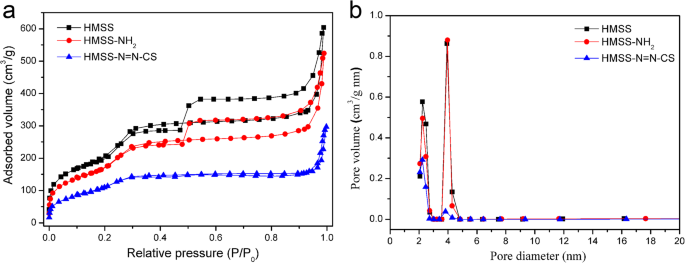
а Изотермы адсорбции / десорбции азота и b Распределение пор по размерам HMSS, HMSS – NH 2 , и HMSS – N =N – CS
Успешность прививки HMSS – N =N – CS проверяли различными методами. Ξ-потенциал HMSS – NH 2 претерпели большие изменения после функционализации, варьирующиеся от -27,9 до + 31,4 мВ, как показано на фиг. 3а, что было приписано добавлению аминогрупп к поверхности HMSS. После HMSS – NH 2 реагировал с азобензол-3,3'-дикарбоновой кислотой с образованием HMSS – N =N-COOH, потенциал ξ дополнительно снизился до -2 мВ из-за карбоксильных групп на поверхности HMSS. После того, как полимер CS был дополнительно привит на поверхность HMSS с образованием HMSS – N =N – CS, потенциал ξ вернулся к + 32,4 мВ. Результат был приписан богатому аминогруппами положительно заряженному покрытию CS на поверхности HMSS [1]. Кривые термогравиметрического анализа (ТГА) HMSS, HMSS – NH 2 , HMSS – N =N – COOH и HMSS – N =N – CS показаны на рис. 3б. По сравнению с HMSS – N =N – COOH, HMSS – N =N – CS потерял дополнительный вес примерно на 19%, что было связано с удалением цепей CS. Прививка азосвязей на поверхность HMSS была также подтверждена изменением цвета во время приготовления HMSS – N =N – COOH, как показано на вставке к рис. 3b. Реагент ГМСС – NH 2 имеет белый цвет, а продукт HMSS – N =N – COOH был желтовато-коричневым после реакции азобензол-3,3'-дикарбоновой кислоты с аминогруппами HMSS. Гидродинамический диаметр ( D H ) и значения индекса полидисперсности (PDI) HMSS, HMSS – NH 2 , и HMSS – N =N – CS определяли в дистиллированной воде, как показано на рис. 3в. HMSS имел диаметр 309 нм и PDI 0,190. После добавления аминогрупп на поверхности HMSS с образованием HMSS – NH 2 , D H увеличился до 324 нм. Диаметр HMSS – N =N – CS был 342 нм, что больше, чем у HMSS – NH 2 . за счет привитых цепей CS. PDI HMSS – N =N – CS (0,177) был меньше, чем у HMSS – NH 2 . , что свидетельствует о том, что средний размер частиц после прививки CS стал еще больше. По сравнению с диаметрами, полученными с помощью ПЭМ, диаметры HMSS и HMSS – N =N – CS, измеренные с помощью DLS, были больше. D H наночастиц измеряли в водной среде с гидратным слоем, в то время как размер наночастиц, полученный с помощью ПЭМ, был получен из сухих наночастиц [3]. ИК-Фурье спектры HMSS – NH 2 , HMSS – N =N – COOH, HMSS – N =N – CS и CS показаны на рис. 4d. По сравнению с пиками для HMSN – NH 2 , увеличение пиков адсорбции при 2853 и 2925 см −1 был отнесен к вибрации - CH 2 в прививке карбоксиконцевых азосвязей. После добавления CS на поверхность HMSS – N =N – COOH наблюдалось увеличение пиков адсорбции при 1660 см −1 и 3435 см −1 , которые были отнесены к υ (C =O) в амидной полосе и колебание N – H в КС. Все результаты подтвердили успешное приготовление HMSS – N =N – CS.
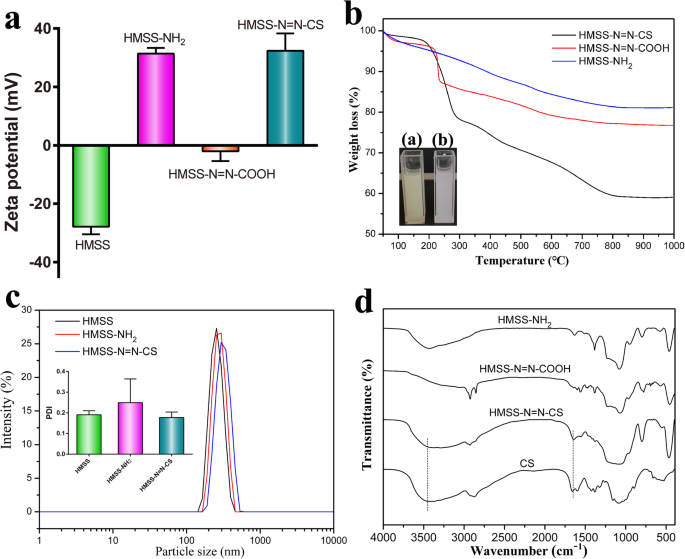
а Соответствующие ξ потенциалы HMSS, HMSS – NH 2 , HMSS – N =N – COOH и HMSS – N =N – CS; б Кривые ТГА HMSS – NH 2 , HMSS – N =N – COOH и HMSS – N =N – CS (на вставке:фотография ( a ) HMSS – N =N – COOH и ( b ) HMSS – NH 2 ); c Распределение по размерам HMSS, HMSS – NH 2 , и HMSS – N =N – CS вставка:соответствующие значения PDI наночастиц; и d ИК-Фурье спектры HMSS – NH 2 , HMSS – N =N – COOH, HMSS – N =N – CS и CS
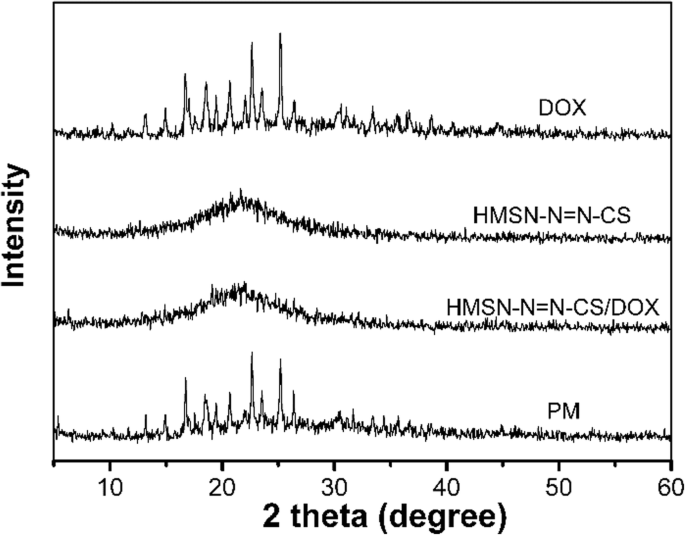
Рентгенограммы DOX, HMSS – N =N – CS, HMSS – N =N – CS / DOX и PM
Состояние препарата и эффективность загрузки
DOX был выбран для исследования поведения HMSS – N =N – CS при загрузке и высвобождении. Когда значение pH суспензии наночастиц HMSS – N =N – CS было доведено до pH 3,5, биополимер CS стал положительно заряженным (pK a CS составило 6,3) за счет протонированных аминогрупп в кислой среде [24]. Полимер CS становится положительно заряженным и набухает, что приводит к открытию мезопор HMSS, что связано с отталкивающим взаимодействием между зарядами CS. Таким образом, DOX получил доступ к мезопорам HMSS – N =N – CS путем диффузии. Однако после того, как смесь, содержащая лекарство, была доведена до 7,4, цепи CS депротонировались и схлопывались, препятствуя преждевременному высвобождению DOX.
УЭ HMSS – N =N – CS / DOX составляет 35,2%, что намного больше, чем у других систем доставки мезопористого диоксида кремния, нагруженных DOX [3, 16]. Высокий уровень LE DOX в наноносителях HMSS объясняется полой полостью, большой площадью поверхности и мезопористой сеткой, которая может использоваться в качестве резервуара для лекарственного средства. Физическое состояние DOX в HMSS – N =N – CS / DOX оценивали с помощью дифракции рентгеновских лучей (XRD). Как показано на профилях XRD (фиг. 4), необработанный DOX демонстрировал характерные и интенсивные пики дифракции кристаллов лекарственного средства. Физическая смесь (PM) HMSS – N =N – CS и DOX также показала явные кристаллические дифракционные пики. Однако не было обнаружено никаких отчетливых кристаллических пиков HMSS – N =N – CS / DOX, что доказало, что физическое состояние DOX в HMSS – N =N – CS / DOX было некристаллическим из-за ограничений мезопористой структуры HMSS.
Ферментативное высвобождение in vitro в симулированной среде толстой кишки
Для исследования ферментативного высвобождения HMSS – N =N – CS, HMSS – N =N – CS / DOX и HMSS / DOX наночастицы добавляли к PBS с pH 7,4 с различными концентрациями смеси ферментов толстой кишки. Как показано на рис. 5a, HMSS – N =N – CS / DOX демонстрирует медленное высвобождение DOX в PBS при pH 7,4, а совокупный процент высвобождения составляет только примерно 10% в течение 24 часов, что указывает на хорошую способность CS к улавливанию. полимеры и азосвязи. Как и ожидалось, в случае разбавления фермента в PBS при pH 7,4 кумулятивное высвобождение DOX улучшилось до более чем 20% за тот же период. Кроме того, количество высвобождаемого DOX резко увеличивалось почти до 40% в присутствии концентрированного фермента. По сравнению с ферментативным высвобождением из HMSS – N =N – CS / DOX, высвобождение DOX из HMSS / DOX имело сходные тенденции в присутствии или отсутствии концентрированного фермента. Относительно низкий процент высвобождения лекарства был обусловлен электростатическим взаимодействием между отрицательно заряженным HMSS и положительно заряженным DOX [42]. Приведенные выше результаты доказывают, что высвобождение DOX из HMSS – N =N – CS / DOX заметно ускоряется ферментами, экстрагированными из микрофлоры в областях толстой кишки. Чувствительный к ферменту механизм высвобождения может заключаться в том, что азосвязи в HMSS – N =N – CS разрушаются ферментом, вызывая отрыв CS от поверхности HMSS и быстрое высвобождение из HMSS. Сообщается, что азо-связи расщепляются ферментами, секретируемыми микрофлорой толстой кишки [34, 35].
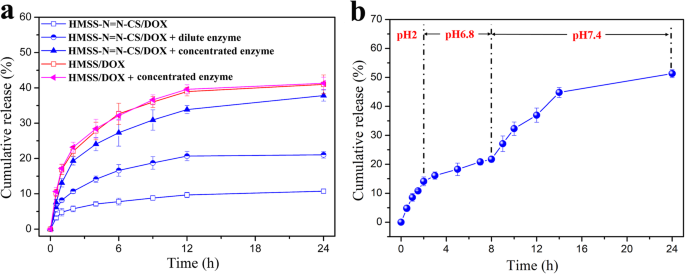
а Профили кумулятивного высвобождения HMSS / DOX и HMSS – N =N – CS / DOX в PBS с pH 7,4 в присутствии концентрированной и разбавленной смеси ферментов толстой кишки; и b поведение in vitro pH-зависимого высвобождения DOX из HMSS – N =N – CS в высвобождающих средах с разными значениями pH
Кроме того, для дальнейшей оценки ферментативного высвобождения из HMSS – N =N – CS / DOX в миметической среде GIT, наноплатформы HMSS – N =N – CS / DOX сначала диспергировали в SGF в течение 2 часов, а затем затем диспергировали в SIF в течение 6 часов и, наконец, носители добавляли к PBS с pH 7,4, содержащему 1 мг / мл экстрагированного фермента. Как показано на фиг. 5b, в моделированном желудочном соке высвобождение DOX было относительно быстрым, и совокупное количество достигло 15% в течение 2 часов. Относительно быстрое высвобождение было связано с более слабым взаимодействием между HMSS – N =N – CS и DOX в кислых условиях, чем в нейтральных [1]. Затем в SIF замедлили высвобождение DOX на 2–8 ч. Однако после того, как HMSS – N =N – CS / DOX инкубировали с экстрагированными ферментами в PBS с pH 7,4, высвобождение DOX продолжало заметно увеличиваться, и кумулятивное количество высвобождения достигло более 50% в течение 24 часов. Неполное высвобождение DOX из HMSS – N =N – CS / DOX произошло из-за сильного взаимодействия между положительно заряженным DOX и отрицательно заряженным HMSS.
Адсорбция белка и стабильность HMSS – N =N – CS
При пероральном введении поверхностные свойства наноносителей неизбежно влияют на поведение при высвобождении лекарств и биоадсорбцию [43]. Анализ адсорбции белка на поверхности использовали для оценки эффекта привитого CS на поверхность HMSS. Как показано на рис. 6а, голые наноносители HMSS имели впечатляющую адсорбцию BSA до 16,5%, что объяснялось большой площадью поверхности и полой полостью HMSS, сильной адсорбционной способностью и неспецифическим взаимодействием между силанольными группами HMSS и BSA [ 38, 39]. Кроме того, HMSS – NH 2 аналогичным образом имел относительно высокое количество адсорбированного БСА 10,2%. Тем не менее, процент адсорбированного БСА на поверхности заметно снизился до 2,5% после добавления полимера CS в качестве покрытия, что резко снизило влияние HMSS – N =N – CS на поведение in vivo. Для дальнейшего наблюдения за стабильностью образцов HMSS – N =N – CS и HMSS, 20 мг HMSS – N =N – CS и HMSS добавляли к PBS с pH 7,4 и деионизированной воде. As displayed in Fig. 6b, although HMSS–N=N–CS and HMSS were relatively stable in water, HMSS quickly flocculated in pH 7.4 PBS. By contrast, the dispersity of HMSS–N=N–CS was obviously enhanced after the polymer CS was grafted onto the surfaces of HMSS. Additionally, HMSS–N=N–CS carriers can remain stable for more than 12 h without precipitation in pH 7.4 PBS. These results proved that covering with the hydrophilic CS polymer could improve the dispersity and decrease protein adsorption on the surface of HMSS–N=N–CS.
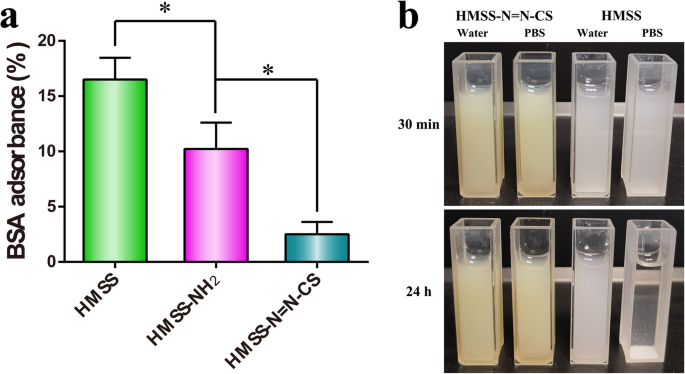
а BSA adsorbance amounts of HMSS and HMSS–NH2 and HMSS–N=N–CS (n =3, *p <0,05). б Photograph images of HMSS–N=N–CS and HMSS dispersed in water and PBS with a concentration of 4 mg/mL
Cellular Uptake
Caco–2 cells, as human epithelial colorectal adenocarcinoma cells, are widely used as model cells in oral drug delivery. As shown in Fig. 7a, Caco–2 cells incubated with free DOX showed a relatively strong fluorescence signal resulting from DOX because positively charged DOX could enter the cell and then the nucleus. Compared with the free DOX group, the HMSS–N=N–CS/DOX group showed a weaker fluorescence signal intensity due to incomplete drug release from HMSS–N=N–CS/DOX. However, after HMSS–N=N–CS/DOX was preincubated with the colonic enzyme mixture for 1 h, it showed a markedly increased fluorescence signal. This was attributed to the azo bonds being cleaved by the enzyme mixture, which led to the removal of the CS from the surfaces of HMSS, thus significantly accelerating the DOX release from HMSS–N=N–CS/DOX. To quantitatively evaluate the cellular uptake differences for HMSS–N=N–CS/DOX and HMSS–N=N–CS/DOX incubated with extracted enzymes, FCM was used. As shown in Fig. 7b, the mean fluorescence intensity (MFI) for the HMSS–N=N–CS/DOX group was 124.7, which was weaker than that of the free DOX group, with a p value less than 0.001. Excitingly, after HMSS–N=N–CS/DOX was preincubated with the colonic enzyme mixture for 1 h, the MFI markedly increased to 357 and even exceeded that of the free DOX group owing to the accelerated drug release from HMSS–N=N–CS/DOX after the breakage of azo bonds. All these results indicated that the azo bonds in HMSS–N=N–CS/DOX could be cleaved in the presence of colonic enzymes, which led to the shedding of CS from the surface of HMSS and accelerated the DOX release from HMSS.
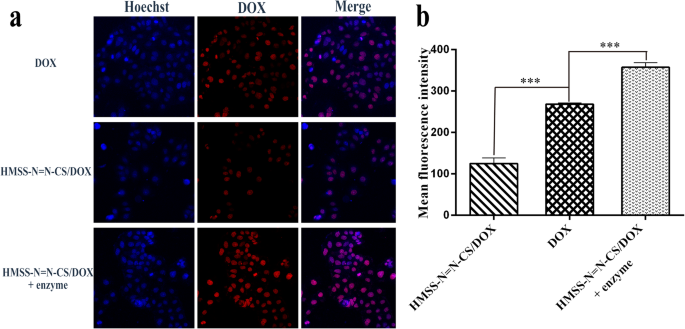
а CLSM of Caco-2 cells incubated with different samples. б The MFI of DOX, HMSS–N=N–CS/DOX, and HMSS–N=N–CS/DOX treated by enzyme measured by FCM in Caco-2 cells (n =3, ***p <0.001)
In Vitro Cell Viability Evaluation
To prove the enzyme-responsive release effect of HMSS–N=N–CS/DOX in simulated colonic conditions, an in vitro cell viability assay was carried out using Caco-2 cells. The classic anticancer drug DOX was used in the cell viability assay. Prior to this assay, different concentrations of blank HMSS and HMSS–N=N–CS were employed to ascertain the biocompatibility of the nanoplatform towards Caco-2 cells and normal NIH-3T3 (mouse embryo fibroblast) cells at various concentrations from 10 to 250 μg/mL by MTT assay [44, 45]. As displayed in Fig. 8a, b, HMSS and HMSS–N=N–CS at different concentrations showed negligible cytotoxicity after incubation with Caco–2 cells or NIH-3T3 cells, and the viability of Caco–2 cells was 87.9% and 88.3% at the high concentration of 100 μg/mL, respectively, which is sufficiently high for clinical applications due to the high drug loading of HMSS. In addition, NIH-3T3 cells incubated with HMSS and HMSS–N=N–CS for 48 h had high cell viability (above 80%) at the relatively high concentration of 100 μg/mL. These results indicated that HMSS and HMSS–N=N–CS are cytocompatible and could be employed for oral delivery.
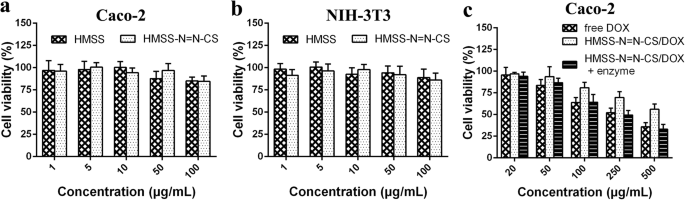
Effect of HMSS and HMSS–N=N–CS on cell proliferation of a Caco–2 cells and b NIH-3T3 cells for 48 h by MTT assay. c Cytotoxicity of free DOX, HMSS–N=N–CS/DOX, and HMSS–N=N–CS/DOX with enzyme against Caco-2 cells with different concentrations for 48 h
The effect of the DOX-loaded nanocarrier HMSS–N=N–CS/DOX on the viability of Caco–2 cells is displayed in Fig. 8c. Free DOX showed strong and concentration-dependent cytotoxicity towards 4T1 cells, which was attributed to the fact that positively charged free DOX could pass through 4T1 cell membranes easily. IC 50 value for the free DOX group was determined to be 10.18 μg/mL using the SPSS Statistics software. Compared with free DOX, HMSS–N=N–CS/DOX exhibited a higher cell viability at the same DOX concentration owing to the incomplete release of DOX from HMSS–N=N–CS induced by the strong electrostatic interactions between negatively changed HMSS carriers and positively changed DOX. IC 50 value for the HMSS–N=N–CS/DOX group was 32.22 μg/mL, which was much higher than that for free DOX. However, HMSS–N=N–CS/DOX preincubated with concentrated colon enzymes showed an obvious concentration-dependent cytotoxicity, and the IC50 value was calculated to be 9.41 μg/mL, which was much lower than that of HMSS–N=N–CS/DOX. This reason could be ascribed to the colon enzymes degrading the azo bonds in HMSS–N=N–CS, which would lead to the detachment of grafted CS from the surface of HMSS, causing the fast release of DOX from HMSS carriers.
Toxicity Studies
The hazards of using HMSS–N=N–CS are a vital factor to be considered before its clinical applications in the future. H&E staining of gastrointestinal mucosa irritation is essential to evaluate the in vivo biosafety of the delivery system for oral administration (Fig. 9a). Compared to a saline group, both the HMSS and HMSS–N=N–CS groups exhibited no marked histopathological changes or hyperemia after oral administration for a week with an administration dose of 100 mg/kg. No death or unusual behaviors of rats was observed during the experimental process. A decrease in body weight is widely regarded as an important and simple index for in vivo systemic toxicity [46]. As shown in Fig. 9b, the body weights of mice in the HMSS and HMSS–N=N–CS groups increased slightly and were similar to those of the saline group. The above results indicated that HMSS and HMSS–N=N–CS showed good biocompatibility as drug carriers for oral administration.
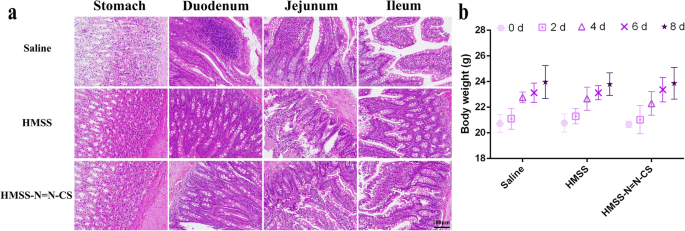
а Gastrointestinal mucosa irritation assay after oral administration of HMSS and HMSS–N=N–CS with the dose of 50 mg/kg for 7 days. б The weight changes of mice after oral administration for a week. Data were means ± SD (n =3)
Выводы
In summary, biodegradable CS was attached through azo bonds to gate the openings of HMSS to achieve enzyme-responsive colon-specific drug delivery. DOX was loaded in the hollow cavity and mesopores of HMSS in a noncrystalline state with a high loading efficiency of 35.2%. Stability and BSA adsorption results illustrated that the CS gates could increase the biocompatibility and stability of HMSS. In vitro release results proved that HMSS–N=N–CS/DOX exhibited enzyme-responsive drug release behavior in the presence of colonic enzymes. CLSM uptake and FCM results indicated that the cellular uptake of DOX was obviously increased after HMSS–N=N–CS/DOX was incubated with the colonic enzyme mixture. Cell viability results indicated that HMSS–N=N–CS/DOX incubated with colonic enzymes showed increased cytotoxicity, and the IC50 value obviously decreased from 32.22 μg/mL for HMSS–N=N–CS/DOX to 9.41 μg/mL upon incubation.
Доступность данных и материалов
Все данные полностью доступны без ограничений.
Сокращения
- HMSS:
-
Hollow mesoporous silica spheres
- CS:
-
Хитозан
- DOX:
-
Доксорубицин
- DDSs:
-
Drug delivery systems
- MSSs:
-
Mesoporous silica spheres
- CLSM:
-
Конфокальная лазерная сканирующая микроскопия
- FCM:
-
Flow cytometry
- FBS:
-
Фетальная бычья сыворотка
- LE:
-
Loading efficiency
Наноматериалы
- Нановолокна и нити для улучшенной доставки лекарств
- Металлоорганические каркасы, реагирующие на окружающую среду, как система доставки лекарств для терапии опу…
- Доставка лекарств на основе клеток для онкологических приложений
- Рыба-данио:многообещающая модельная система в реальном времени для доставки нейроспецифических лекарств, оп…
- PLGA-липидные наночастицы с отслеживанием 131I как носители доставки лекарств для целевого химиотерапевтическо…
- Наночастицы кремнезема для доставки внутриклеточного белка:новый подход к синтезу с использованием зеленог…
- Наноносители на основе нуклеозидов и липидов для доставки сорафениба
- Полые наносферы кремнезема, инкапсулированные пероксидазой хрена для внутриклеточного определения активны…
- Исследование физико-химических характеристик системы на основе нанолипосом для двойной доставки лекарств
- Микророботы, напечатанные на 3D-принтере, обещают доставку лекарств



