Функционализированные гиалуроновой кислотой наночастицы оксида гадолиния для лучевой терапии опухолей под контролем магнитно-резонансной томографии
Аннотация
Неточность локализации и собственная радиорезистентность солидных опухолей серьезно препятствовали клиническому применению лучевой терапии. В этом исследовании мы изготовили функционализированные гиалуроновой кислотой наночастицы оксида гадолиния (HA-Gd 2 О 3 НЧ) с помощью гидротермального процесса в одном сосуде для эффективной магнитно-резонансной (МР) визуализации и радиосенсибилизации опухолей. Благодаря функционализации HA, свежеприготовленный HA-Gd 2 О 3 НЧ диаметром 105 нм показали благоприятную диспергируемость в воде, низкую цитотоксичность и отличную биосовместимость и легко проникали в цитоплазму раковых клеток посредством эндоцитоза, опосредованного рецептором НА. Важно отметить, что HA-Gd 2 О 3 НЧ проявляли высокую продольную релаксирующую способность ( r 1 ) 6.0 мМ −1 S -1 в качестве контрастных агентов для МРТ и повышения радиосенсибилизации дозозависимым образом. Эти находки продемонстрировали, что синтезированный HA-Gd 2 О 3 НЧ как бифункциональные тераностические агенты имеют большой потенциал в диагностике опухолей и лучевой терапии.
Введение
Лучевая терапия широко применяется при раке, которая включает в себя высокоэнергетическое рентгеновское излучение и нанесение доз облучения на участки опухоли, вызывая повреждение свободными радикалами или повреждение ДНК [1,2,3,4]. Однако низкая радиочувствительность, неточность локализации опухоли и плохое различение поражений и нормальных тканей, вызывающих побочные эффекты облучения, ограничивают клиническое применение лучевой терапии [5]. Поэтому важно разработать методы повышения радиочувствительности опухоли при минимизации системных побочных эффектов. Комбинация нанотехнологий и лучевой терапии является общепризнанным приоритетом радиосенсибилизации.
В последние годы нанотехнологии считаются привлекательной стратегией диагностики и лечения рака [6,7,8,9,10,11]. Одной из основных функций наночастиц (НЧ) является точное нацеливание на опухоль, основанное на избирательном накоплении НЧ в тканях опухоли посредством пассивного нацеливания, эффекта повышенной проницаемости и удерживания (EPR), активного нацеливания и увеличенного времени циркуляции [12, 13,14]. Наша предыдущая работа продемонстрировала, что легирование углеродных наночастиц гетероатомами эффективно регулирует их внутренние свойства и вносит полезные свойства [15,16,17]. Интересно, что НЧ можно использовать в качестве радиосенсибилизаторов [18]. НЧ тяжелых металлов (с высоким содержанием Z-элементов) (например, Au, Bi, Gd) в качестве перспективных радиосенсибилизаторов могут быть использованы в радиосенсибилизирующей терапии из-за их высокого сечения захвата рентгеновских фотонов и эффекта комптоновского рассеяния [19]. Когда рентгеновские лучи взаимодействуют с наночастицами с высоким Z, оже-электронами и фотоэлектронами, выброс вторичных электронов повреждает раковые клетки, обеспечивая повышение дозы во время лучевой терапии [20]. На сегодняшний день показано, что НЧ на основе гадолиния (GdNP) являются эффективными контрастными агентами (КА) МРТ [21, 22] и позволяют дифференцировать нормальную ткань от пораженной ткани и поражений неинвазивным способом и в режиме реального времени. Эти агенты сокращают время продольной релаксации, чтобы повлиять на продольную релаксацию r 1 [23], и их неточное нацеливание часто приводит к побочным эффектам. Хорошо известно, что гиалуроновая кислота (НА) является основным лигандом и носителем доставки лекарств к сайтам-мишеням с рецепторами НА, такими как кластерная детерминанта 44 (CD44) [24,25,26].
Основываясь на результатах предыдущих исследований, мы использовали HA в качестве целевого лиганда для функционализации Gd 2 О 3 НЧ с двойной функцией:эффективные МРТ-КА, нацеленные на опухоль, и радиосенсибилизаторы для преодоления присущей радиорезистентности и неточности локализации опухоли. Кроме того, HA-Gd 2 О 3 НЧ проявляют высокую продольную релаксацию ( r 1 ) как многообещающие агенты для МРТ с лучшим качеством МРТ. По сравнению с доступными в настоящее время центрами сертификации [27, 28], в результате HA-Gd 2 О 3 НП демонстрируют три значительных преимущества:во-первых, HA-Gd 2 О 3 НЧ демонстрируют благоприятную биосовместимость благодаря использованию естественного внеклеточного матрикса в качестве предшественников. Во-вторых, функционализация HA значительно улучшает нацеливание на опухоль и снижает побочные эффекты. Наконец, HA-Gd 2 О 3 НП обладают бифункциональной способностью в диагностике и терапии. Чтобы проверить эффективность и изучить механизм повышения радиосенсибилизации, мы оценили радиосенсибилизирующий эффект HA-Gd 2 О 3 НЧ влияют на жизнеспособность опухолевых клеток, клеточный цикл и апоптоз.
Результаты и обсуждение
Подготовка и характеристика HA-Gd 2 О 3 НП
В этом исследовании HA-Gd 2 О 3 НЧ были успешно получены с использованием простого гидротермального процесса, как показано на схеме 1. Размеры частиц анализировали с помощью динамического светорассеяния, а морфологические исследования проводили с помощью просвечивающей электронной микроскопии. Как показано на рис. 1a, HA-Gd 2 О 3 НЧ имели однородную дисперсию и дискретные квазисферические формы без видимой агрегации. Средние диаметры HA-Gd 2 О 3 НЧ имели размер 105 нм. По сравнению с нормальными тканями капиллярная эндотелиальная проницаемость опухолевых тканей была увеличена, а эндотелиальная щель составляла 100-600 нм [29]. Следовательно, НЧ желаемого размера легко погружались в ткани опухоли, и они могут значительно повысить эффективность доставки лекарств с пассивным нацеливанием.
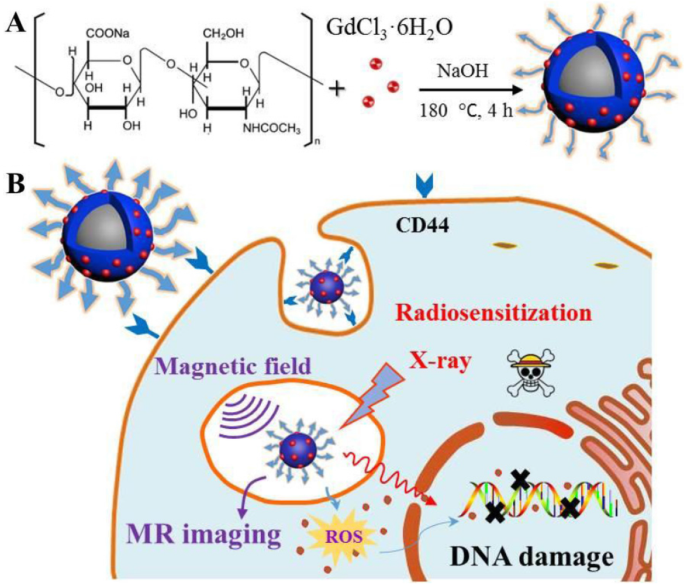
Схема синтеза HA-Gd 2 О 3 НЧ гидротермального метода (A) и следующих биомедицинских приложений (B)
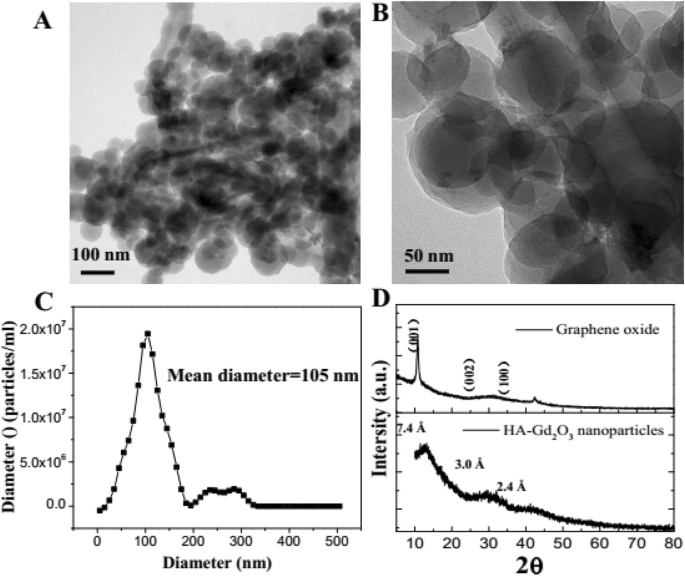
Характеристика HA-Gd 2 О 3 НП. Низкий ( a ) и высокий ( b ) увеличение изображений ПЭМ. Распределение диаметров ( c ) и рентгенограммы ( d ) из HA-Gd 2 О 3 НП
Фазовый состав HA-Gd 2 О 3 НЧ исследовали методом XRD с использованием мощности оксида графита (GO) в качестве контроля. Как показано на рис. 1d, один основной дифракционный пик (2 θ =12,04 °) и два второстепенных пика (2 θ =29,6 °, 42,1 °) наблюдались в HA-Gd 2 О 3 Дифракционная картина НП, соответствующая характеристическим пикам ГО (плоскость 100) и графита (плоскость 002) соответственно. Основной шаг решетки HA-Gd 2 О 3 НЧ показали меньшее расстояние (0,73 нм, рассчитанное по формуле Брэгга), чем расстояние GO d 001 =0,85 нм, где смещение пика вверх может быть связано с уменьшением расстояния между sp 3 слои. Все широкие дифракционные пики демонстрируют, что HA-Gd 2 О 3 НЧ имели аморфную структуру, что может быть связано с сильно разупорядоченным углеродом и снижением sp 2 (C – C) расстояние между слоями в процессе карбонизации. Результат дополнительно указал HA-Gd 2 О 3 НЧ с плохой кристаллической природой обладали гетерогенной многослойной структурой, что согласуется с нашими предыдущими отчетами об углеродных точках [30, 31].
Химическая структура и состав поверхности HA-Gd 2 О 3 НП
Поверхностные функциональные группы и состав HA-Gd 2 О 3 НЧ исследовались с помощью инфракрасного спектра с преобразованием Фурье и рентгеновской фотоэлектронной спектроскопии. Как показано на рис. 2a, спектр XPS показал четыре типичных пика при 284,0, 400,0, 530,6 и 1188,5 эВ, что указывает на то, что HA-Gd 2 О 3 НЧ в основном состоят из элементов гадолиния, углерода, кислорода и водорода. Спектр высокого разрешения Gd 3 d (Рис. 2b) выявило наличие двух сильных пиков при 1187,5 эВ и 1221 эВ, соответствующих спин-орбитальному расщеплению 32 эВ, соответствующих 3 d 5/2 и 3 д 3/2 уровни энергии Gd. Эти наблюдения хорошо согласуются с предыдущими отчетами о HA-Gd 2 О 3 НП. О (1 s ) в спектре, показанном на рис. 2c, преобладает один главный пик, расположенный при 531,4 эВ, который соответствует связи между O 2- и Б-г 3+ . FITR-спектроскопия была проведена как для голого, так и для HA-Gd 2 О 3 Образцы НП (рис. 2г). Для образцов без покрытия, как показано на рис. 2а, характерные полосы поглощения v как O – C – O на 1580 и 1380 см −1 выявили наличие карбонатной группы. Широкие пики на 3340 и 2900 см −1 были отнесены к валентным колебаниям O – H и C – H соответственно, что соответствовало поверхностно-адсорбированной воде. Для HA-Gd 2 О 3 НЧ, валентные колебания COO - на 1580 и 1380 см −1 были усилены, что указывает на введение карбоксильной группы гиалуроновой кислоты. Эти результаты показали, что функциональные группы HA-Gd 2 О 3 НЧ в основном содержат некоторые многочисленные карбонильные, карбоксилатные и гидроксильные группы. Наличие этих функциональных групп, расположенных на поверхности, наделенной HA-Gd 2 О 3 НЧ с отличной диспергируемостью в воде. Важно отметить, что ион Gd, внедренный в поверхность наночастиц, может быть полезен для МР-визуализации и радиосенсибилизации, что значительно предотвращает утечку иона Gd в окружающую среду.
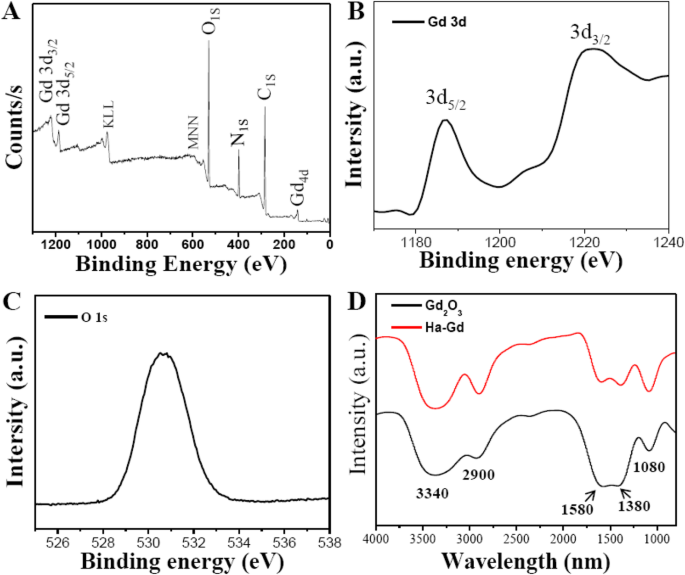
Химическая структура и состав HA-Gd 2 О 3 НП. а XPS-спектр полного сканирования HA-Gd 2 О 3 НП. б Б-г 3d спектр. c О 1S спектр. г ИК-Фурье-спектр HA-Gd 2 О 3 НП
Биосовместимость HA-Gd 2 О 3 НП
Биосовместимость HA-Gd 2 О 3 НЧ как потенциальные биомедицинские агенты имеют решающее значение для их биомедицинского применения. Во-первых, цитотоксичность, присущая HA-Gd 2 О 3 НЧ оценивали в клетках HepG2 и VSMC с помощью анализа CCK-8. Как показано на рис. 3a и S. Рис. 1, HA-Gd 2 О 3 НЧ не проявляли явной цитотоксичности до 3 дней. Даже при концентрации 200 мкг / мл после 24-часовой выдержки жизнеспособность клеток составляла примерно 90%. Во-вторых, гемосовместимость HA-Gd 2 О 3 НЧ in vivo оценивали с помощью анализа гемолиза. Как показано на рис. 3b, мы наблюдали гемолиз эритроцитов в воде (положительный контроль). Напротив, после HA-Gd 2 очевидного гемолиза не наблюдалось. О 3 Инкубация НЧ при различных концентрациях от 0 до 200 мкг / мл в течение 2 ч, что было аналогично результатам для раствора PBS (отрицательный контроль). По сравнению с отрицательным контролем процент гемолиза при различных концентрациях HA-Gd 2 О 3 НЧ немного оценивали на основании поглощения супернатанта при 541 нм. Результаты показали, что процент гемолиза HA-Gd 2 О 3 Все НЧ составляли менее 3% в исследуемой концентрации, что свидетельствует об их благоприятной гемосовместимости. Чтобы изучить потенциальную токсичность, HA-Gd 2 О 3 НЧ вводили внутривенно мышам Balb / c (как показано на S. Рис. 2). Через 1 неделю этих мышей казнили, а мочевой пузырь, почки и селезенку собирали для анализа патологических срезов. Как показано на S. Рис. 2, результат патологических срезов показал, что не было наблюдаемого поражения или воспалительной реакции в органах HA-Gd 2 О 3 Мыши, получавшие NP. Эти результаты ясно показали, что синтезированный HA-Gd 2 О 3 НЧ обладают хорошей цитосовместимостью и хорошей гемосовместимостью.
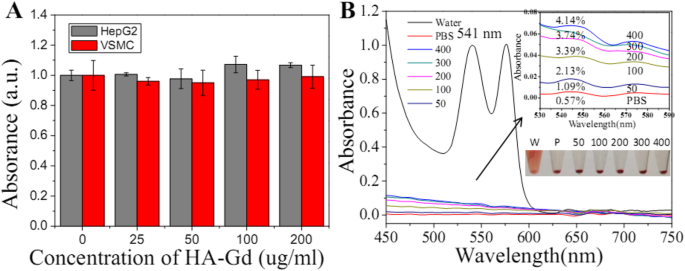
а Эффект HA-Gd 2 О 3 НЧ на жизнеспособность клеток HepG2 и VSMC с использованием анализа CCK-8. б Гемолитическая активность HA-Gd 2 О 3 НЧ в разных концентрациях (50, 100, 200, 300 и 400 мкг / мл). PBS и вода использовались в качестве отрицательного и положительного контроля соответственно
Фантомное исследование МРТ
Продольный ( T 1 ) времена релаксации HA-Gd 2 О 3 НЧ исследовали in vitro вместе с коммерческим контрастом Magnevist (Gd-DTPA) в качестве контроля с использованием фосфатно-солевого буфера (pH =7,4, 0,2 М). С увеличением концентрации Gd интенсивность сигнала T 1 -вес фантомных изображений явно увеличился, что указывает на то, что все образцы могут давать усиление контрастности МРТ на T 1 -взвешенные последовательности (рис. 4а). Кроме того, графики зависимости интенсивности сигнала от времени инверсии дали T 1 -время релаксации каждого контрастного вещества при определенных концентрациях. Как показано на рис. 4b, r 1 значение HA-Gd 2 О 3 НЧ составили 6,0 мМ -1 . S -1 , что было значительно выше, чем у Магневиста (3,86 мМ −1 S -1 ) при тех же условиях. Расширенный r 1 можно приписать гораздо большему гидродинамическому радиусу и площади поверхности HA-Gd 2 О 3 НП; таким образом, большее количество атомов Gd, легированных в решетку НЧ, стало доступным для молекул воды, сокращая продольную релаксацию и увеличивая r 1 значение.
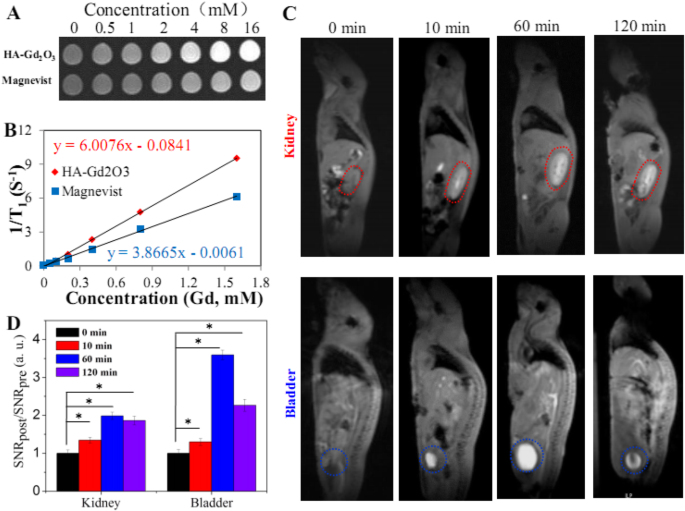
а Т 1 фантомные изображения HA-Gd 2 О 3 НЧ с разной концентрацией общих ионов Gd. б Соответствующие участки 1 / T 1 против концентраций общих ионов Gd. c In vivo T 1 МРТ и анализ мышей после внутривенной инъекции HA-Gd 2 О 3 НЧ как контрастные вещества. г Количественная оценка изменений сигнала (отношения SNR) в мочевом пузыре и почках в разные моменты времени после введения ( n =3). * p <0,05
МРТ In Vivo
Чтобы определить потенциальное применение in vivo, характеристики МРТ и судьба циркуляции HA-Gd 2 О 3 НЧ (10 мг / кг) исследовали с использованием сканера МРТ на нормальных мышах BALB / c в качестве модели. По сравнению с изображениями до инъекции (рис. 4c), более яркие области почек и мочевого пузыря, показанные пунктирными кружками, четко наблюдались через 10 минут после инъекции, демонстрируя, что HA-Gd 2 О 3 NP могут использоваться как CA для улучшения T 1 релаксация в этих основных органах in vivo. Важно отметить, что усиление контраста HA-Gd 2 О 3 НЧ сохранялись до 60 минут после инъекции, что было намного дольше, чем у малых молекул комплекса Gd (период полураспада около нескольких минут у мелких животных) [27], что указывает на то, что HA-Gd 2 О 3 НЧ обладают более длительным временем удерживания in vivo, чем коммерческий контраст. Для количественного анализа эффекта контрастности МРТ мы вычислили отношение сигнал / шум (SNR), тщательно проанализировав интересующие области изображений МРТ, и вычислили значения SNR post / SNR pre для представления относительного усиления сигнала (RSE) (рис. 4d). Значения RSE HA-Gd 2 О 3 НЧ в почке были 1,35, 1,99 и 1,86. Точно так же значения RSE HA-Gd 2 О 3 NP в мочевом пузыре были выше, чем в почках (1,29, 3,59 и 2,26). HA-Gd 2 О 3 НЧ большого размера (более 100 нм) демонстрируют длительное время циркуляции, после чего могут выводиться желчно-кишечным путем, согласно ранее полученным результатам [32]. Более того, увеличенное время циркуляции in vivo могло увеличить пассивное нацеливание на опухоли за счет усиления эффекта EPR.
Визуализация опухоли
HA-Gd 2 О 3 НЧ с превосходными характеристиками МРТ и длительным временем циркуляции предоставляют прекрасные возможности для визуализации опухолей с помощью эффекта ЭПР. Таким образом, мы создали модели подкожной опухоли печени, чтобы исследовать, можно ли обнаружить гепатоцеллюлярные карциномы (ГЦК) с помощью HA-Gd 2 О 3 МРТ с усилением НП. После внутривенного введения HA-Gd 2 О 3 НЧ мы наблюдали, что подкожная область опухоли становится ярче, чем окружающая ткань, как видно при коронарном и поперечном сканировании (рис. 5а). RES подкожной опухоли резко достиг 1,54 и 1,83 при поперечном и корональном сканировании, соответственно, что указывает на эффективное накопление HA-Gd 2 О 3 НЧ в области опухоли за счет эффекта ЭПР. Эти результаты показывают, что HA-Gd 2 О 3 НЧ очень чувствительны для МРТ-визуализации опухолей. Многие исследования показали, что длительное время циркуляции может способствовать эффективности пассивного нацеливания через протекающую сосудистую сеть солидных опухолей [33].
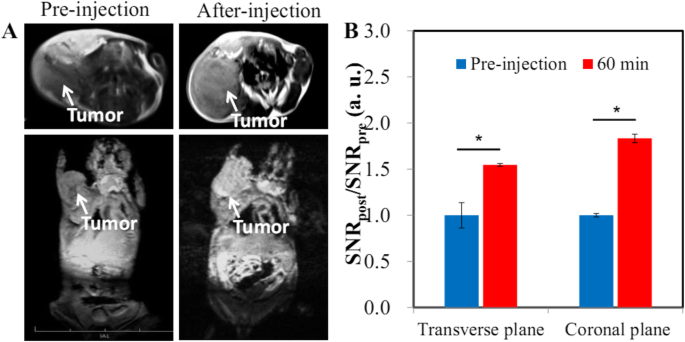
Т 1 -взвешенная МРТ ( a ) и соответствующий количественный анализ ( b ) опухолей ксенотрансплантата рака печени мыши Heps после внутривенной инъекции HA-Gd 2 О 3 НП
Повышение радиосенсибилизации HA-Gd 2 О 3 НП
Отличная производительность HA-Gd 2 О 3 НП как T 1 Контрастное вещество побудило нас точно определить его место в радиосенсибилизации опухолей. Во-первых, с помощью анализа CCK-8 исследовали, произошло ли увеличение дозы при таком комбинированном лечении. Как показано на рис. 6а, одиночный HA-Gd 2 О 3 НЧ (концентрация 0–200 мкг / мл) не оказывали значительного влияния на жизнеспособность HepG-2, но облучение рентгеновскими лучами (диапазон 0–9 Гр) снижало жизнеспособность клеток HepG-2 до менее 70% при 9 Гр. Важно отметить, что комбинация рентгеновского облучения с HA-Gd 2 О 3 НЧ резко снижали жизнеспособность клеток HepG-2 до менее чем 50%, особенно при концентрации 200 мкг / мл при 9 Гр. Затем был проведен клоногенный анализ для оценки жизнеспособности клеток в клетках HepG-2 после комбинации рентгеновского облучения и HA-Gd 2 О 3 НП. Как показано на рис. 6b, одиночный HA-Gd 2 О 3 НЧ не оказывали существенного влияния на образование колоний клеток HepG-2, но облучение рентгеновскими лучами уменьшало образование колоний клеток HepG-2 до 46,7%. Однако лечение рентгеновским облучением и HA-Gd 2 О 3 НЧ заметно подавляли жизнеспособность клеточных колоний до 29,8%. Соответствующие изображения дополнительно подтвердили радиосенсибилизацию HA-Gd 2 О 3 НП против клеток HepG-2.
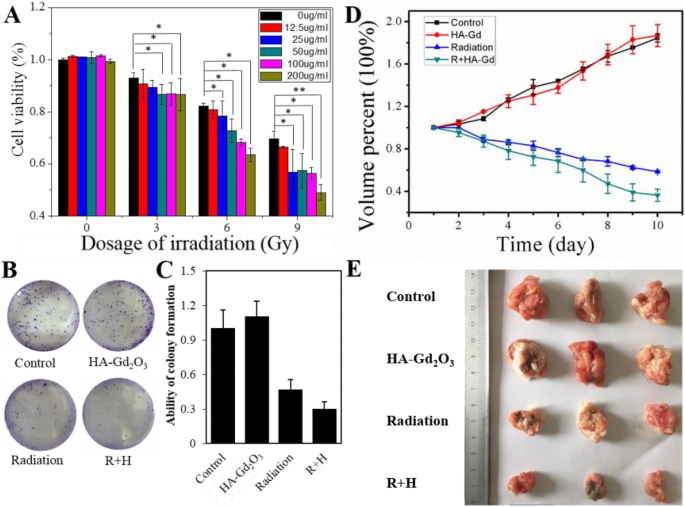
Эффект радиосенсибилизации HA-Gd 2 О 3 НЧ in vitro. а Синергетический эффект HA-Gd 2 О 3 НЧ (0 мкг / мл, 12,5 мкг / мл, 25 мкг / мл, 50 мкг / мл, 100 мкг / мл и 200 мкг / мл) и рентгеновское излучение (0 Гр, 3 Гр, 6 Гр и 9 Гр). Gy) на жизнеспособность клеток HepG2 с помощью анализа CCK-8. * p <0,05, ** p <0,01, разница была статистически значимой. б Анализы выживаемости колоний клеток HepG2, обработанных HA-Gd 2 О 3 НЧ и рентгеновское излучение и c соответствующий количественный анализ возможностей клоногенеза. г Кривые роста объема опухоли у разных групп мышей после различных обработок. Группы: a контроль, b излучение, c HA-Gd 2 О 3 НП и d излучение + HA-Gd 2 О 3 НП. е Фотографии опухолей, полученные у разных групп мышей по окончании лечения
Эффективность лучевой терапии in vitro побудила нас применить HA-Gd 2 О 3 НЧ в сочетании с облучением для контроля роста опухоли у мышей с опухолью. Объемы опухолей в контроле и одиночном HA-Gd 2 О 3 Лечение НП быстро росло, и оба увеличились на 180%. По сравнению с обработкой однократным облучением 58%, HA-Gd 2 О 3 НЧ в сочетании с облучением показали эффективное подавление опухоли на 38% после 10 дней облучения (рис. 6d). Опухоль была сфотографирована, и средний объем опухоли в каждой группе показал, что средний объем опухоли в группе (a) был самым высоким, а в группе (d) был самым низким среди всех групп (фиг. 6e). Эти результаты показывают, что свежеприготовленный HA-Gd 2 О 3 НЧ перспективны для подавления роста опухолей под воздействием рентгеновского излучения.
Для дальнейшего понимания механизма радиосенсибилизации при комбинированном лечении HA-Gd 2 были проведены проточно-цитометрический анализ и анализ окрашивания живых / мертвых животных. О 3 НЧ и рентгеновское излучение. Как показано на фиг. 7a, интенсивная зеленая флуоресценция без красного наблюдалась в клетках HepG-2, обработанных одним HA-Gd 2 О 3 НЧ, подтвердившие высокую жизнеспособность клеток. Небольшое количество красной флуоресценции наблюдалось после обработки рентгеновским излучением, что указывает на низкий уровень апоптоза клеток. Однако сильная красная флуоресценция наблюдалась после комбинированной обработки HA-Gd 2 О 3 НЧ (200 мкг / мл) и облучение, демонстрирующие, что HA-Gd 2 О 3 НЧ могут значительно усилить апоптоз клеток, индуцированный рентгеновским облучением. Механизм радиосенсибилизации HA-Gd 2 О 3 Далее НЧ исследовали с помощью проточной цитометрии. Как показано на рис. 7b, одиночное излучение и HA-Gd 2 О 3 НЧ вызывали остановку фазы G2 / M на 27,55% и 19,12% соответственно. Однако комбинированное лечение HA-Gd 2 О 3 НЧ и радиация заметно увеличивали задержку фазы G2 / M в диапазоне от 30,89 до 33,27% в зависимости от дозы. Между тем, комбинированное лечение вызывало гибель апоптотических клеток с 10,63 до 22,67%, что отражается в пропорциях суб-G1, когда один HA-Gd 2 О 3 НЧ и радиация индуцированы 3,02% и 13,87%. Для дальнейшего изучения возможного механизма гибели клеток был проведен метод аннексина V-EGFP / PI с помощью проточной цитометрии. Сигнал эмиссии аннексина V-EGFP был нанесен на график x по оси, в то время как сигнал излучения PI был нанесен на y -ось (рис.8). Количество клеток некроза, клеток раннего апоптоза, клеток позднего апоптоза и живых клеток определяли процентным содержанием аннексина V - / PI + (Q3), Аннексин V + / PI + (Q2) и Аннексин V - / PI - (Q4) соответственно. Процент апоптоза клеток в контрольной группе и одиночном HA-Gd 2 О 3 Группа НП (100 мкг / мл) составляла менее 5%, что приводило к незначительному влиянию. По сравнению с группами, получавшими однократное облучение (8,8%), скорость апоптоза комбинации HA-Gd 2 О 3 НЧ и радиация увеличивались с увеличением концентрации от 50 до 200 мкг / мл. В частности, уровень раннего апоптоза клеток, очевидно, увеличился до 33,2%, а ранний и поздний апоптоз достиг 44,3% при концентрации 200 мкг / мл. Как правило, комбинация HA-Gd 2 О 3 НЧ и рентгеновское облучение оказывали синергетический эффект на образование клеточных колоний, жизнеспособность клеток дозозависимым образом и эффект усиления радиосенсибилизации. На основании этих результатов HA-Gd 2 О 3 НЧ могут быть эффективной альтернативой для повышения радиосенсибилизации при лучевой терапии.
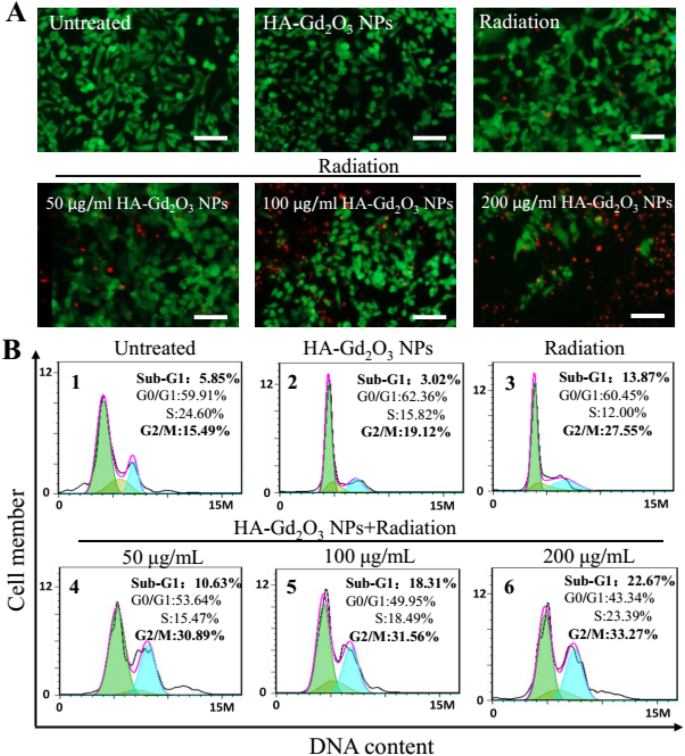
Повышение дозы облучения HA-Gd 2 О 3 НП. а Окрашивание живых мертвецов клеток HepG2. Зеленый (окраска флуоресцеиндиацетатом) =живые клетки, красный (окраска йодистым пропидием) =мертвые клетки. Шкала шкалы =200 мм. б Распределение клеточного цикла после различных обработок было проанализировано путем количественного определения содержания ДНК с помощью анализа проточной цитометрии
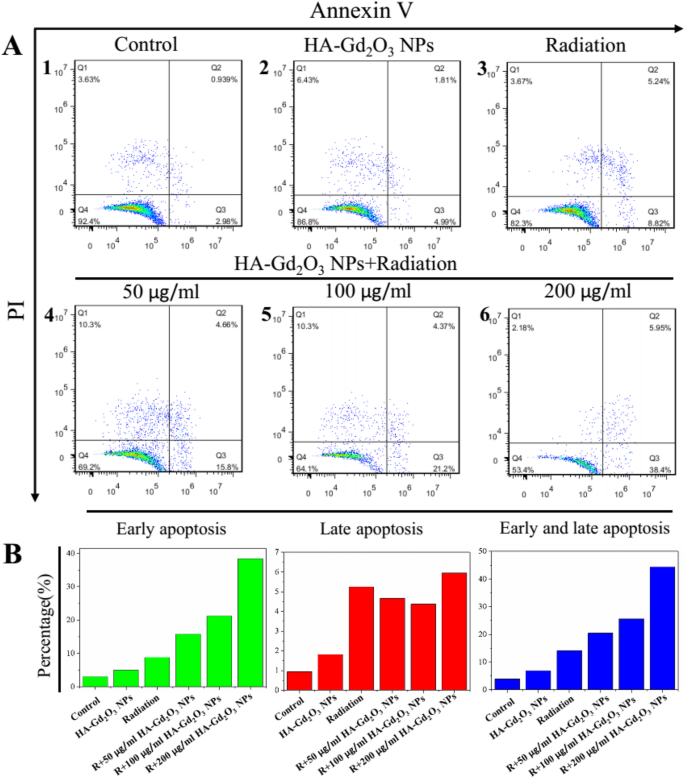
Анализ апоптоза HA-Gd 2 О 3 НП. а Уровни апоптоза клеток HepG-2 через 24 ч после обработки рентгеновским излучением. б Соответствующий количественный анализ
Выводы
В заключение мы разработали бифункциональный HA-Gd 2 О 3 НЧ для эффективной МРТ и радиосенсибилизации опухолей в гидротермальном процессе в одном сосуде. После покрытия HA синтезированный HA-Gd 2 О 3 НЧ обладают хорошей диспергируемостью в воде и отличной биосовместимостью. Результирующий HA-Gd 2 О 3 НЧ, инкапсулирующие атомы Gd, не только эффективно демонстрируют высокую продольную релаксивность ( r 1 ) для МРТ как T 1 контрастный агент, но также повышает радиочувствительность опухолей, вызывая апоптоз клеток и блокируя клеточный цикл в качестве радиосенсибилизатора. Таким образом, роман HA-Gd 2 О 3 НЧ обладают многообещающим потенциалом для диагностики опухолей и лучевой терапии.
Материалы и методы
Материалы
Флуоресцеина диацетат (FDA) и йодид пропидия (PI) были приобретены у Sigma (Нью-Йорк, Нью-Йорк, США). GdCl 3 · 6H 2 О, этиленгликоль (99%) был приобретен у Hengrui Pharmaceutical Co., Ltd. (Ляньюньган, Цзянсу, Китайская Народная Республика). Набор для подсчета клеток-8 (CCK-8) был куплен в Додзиндо (Кумамото, Япония). NaH 2 ЗП 4 , Na 2 HPO 4 , и H 2 SO 4 были получены из Института тонких химических исследований Гуанфу (Нанкай, Тяньцзинь, Китайская Народная Республика). Фетальная бычья сыворотка и минимальная необходимая среда Дульбекко (DMEM) были приобретены у Invitrogen China Limited (Шанхай, Китайская Народная Республика). Все химические вещества были аналитической чистоты и использовались без дополнительной очистки.
Синтез HA-Gd 2 О 3 НП
HA-Gd 2 О 3 НЧ были приготовлены с использованием гидротермального метода в одном сосуде следующим образом:сначала 0,1 г НА растворяли в 20 мл воды при интенсивном перемешивании при температуре окружающей среды в течение ночи. Впоследствии 0,1 г GdCl 3 · 6H 2 Добавляли О и 0,5 мл NaOH (1 М) соответственно. Затем смесь перемешивали еще 5 мин до образования гомогенного прозрачного раствора и переносили в автоклав объемом 50 мл, герметично закрывали и гидротермически обрабатывали при 120 ° C в течение 6 часов. После естественного охлаждения до комнатной температуры прозрачную суспензию фильтровали через мембрану 0,22 мкм для удаления любых крупных агломератов. Затем приготовленный раствор подвергали диализу против воды в течение 3 дней в диализном мешке с отсечкой по молекулярной массе 14 кДа. Диализный раствор собирали и сушили вымораживанием с использованием вакуумной сублимационной сушилки. HA-Gd 2 О 3 Таким образом были получены порошки NP, которые были сохранены для дальнейшего изучения.
Инструменты и характеристики
Морфологии HA-Gd 2 О 3 НЧ исследовали методом просвечивающей электронной микроскопии высокого разрешения на микроскопе JEM-2100 (JEOL, Токио, Япония) при ускоряющем напряжении 200 кВ. Элементный состав HA-Gd 2 О 3 НЧ определяли с помощью измерений XPS на фотоэлектронном спектрометре MK II с использованием Al-Ka (1486,6 эВ) в качестве источника рентгеновского излучения и инфракрасного спектрометра с преобразованием Фурье (FTIR) (Nicolet Nexus 470, GMI, Ramsey, MN, USA). Кристаллическая структура HA-Gd 2 О 3 НЧ охарактеризовали с помощью рентгенограмм на дифрактометре Rigaku-D / MAX2500 (Rigaku, Япония), оборудованном Cu Kα ( λ =0,15405 нм) излучения со скоростью сканирования 4 ° / мин в диапазоне от 5 до 80 °.
Анализ жизнеспособности клеток
Влияние HA-Gd 2 О 3 НЧ на жизнеспособность клеток изучали с помощью набора для подсчета клеток CCK-8 assay (CCK-8 assay). HepG2 (гепатокарцинома человека, номер АТСС:HB-8065) и VSMC (клетки гладких мышц сосудов) высевали в 96-луночный планшет с плотностью 3 × 10 3 клеток / лунку и культивировали при 37 ° C в 5% CO 2 инкубатор в течение 24 часов, затем с использованием DMEM, содержащей различные концентрации HA-Gd 2 О 3 НЧ (0 мкг / мл, 25 мкг / мл, 50 мкг / мл, 100 мкг / мл и 200 мкг / мл) заменяют питательную среду. После инкубации еще 4 ч с добавлением 10 мкл раствора CCK-8 в каждую лунку клетки инкубировали 4 ч в темном месте. Поглощение измеряли при 490 нм с использованием Multi-Mode Microplate Reader Synergy HT (Bio Tek, Winooski, VT, USA). Необработанные клетки (в DMEM) использовали в качестве контроля, а относительную жизнеспособность клеток (среднее SD, n =5) был выражен как Abssample / Abscontrol × 100%.
Анализ гемолиза
Вкратце, возраст 19–21 г 6-недельных самок мышей BALB / c был любезно подготовлен в соответствии с Правилами содержания животных Министерства здравоохранения Китайской Народной Республики. Три миллилитра крови, стабилизированной гепарином натрия, получали при удалении глазных яблок. Затем его центрифугировали для удаления супернатанта со скоростью 1200 об / мин, 15 мин согласно литературным данным. После этого промывают осадок с помощью PBS пять раз для получения красных кровяных телец мыши (MRBC), затем отбирают около 3 мл крови путем удаления глазного яблока, стабилизируют с помощью гепарина натрия, центрифугируют (1, 200 об / мин, 15 мин) для удаления супернатанта согласно литературным данным [27] промывали PBS пять раз для получения эритроцитов мыши (MRBC). Разбавляя в десять раз PBS, 0,1 мл MRBC переносили в пробирки на 1,5 мл, предварительно заполненные 0,9 мл PBS, содержащими различные концентрации частиц (50–200 мкг / мл) HA-Gd 2 О 3 НЧ, 0,9 мл воды (в качестве положительного контроля) и 0,9 мл PBS (в качестве отрицательного контроля) соответственно. Смесь инкубировали 2 ч при комнатной температуре после легкого встряхивания, затем центрифугировали при 12000 об / мин в течение 1 мин. Наконец, были сделаны фотографии всех образцов и измерена оптическая плотность супернатанта (гемоглобина) с помощью спектрофотометра UV-2450 UV-Vis. Процент гемолиза различных образцов был рассчитан путем деления разницы в оптической плотности между образцом, положительным и отрицательным контролем при 541 нм.
МР-фантомное исследование in vitro и in vivo
МРТ-изображения in vitro и in vivo получали на МРТ-сканере 3 Тесла (Magnetom Trio Tim, Siemens, Германия). Чтобы изучить T 1 фантомные изображения in vitro, раствор HA-Gd 2 О 3 NPs with different concentrations ranging from 0 to 16 mM was added to a 96-well culture plate, using the Magnevist (commercial MR contrast agent, Gd-DTPA) as control. For MR imaging in vivo, we chose the normal BALB/c mice as the model (n =4). Animal experiments were strictly conformed to the Animal Management Rules of the Ministry of Health of the People’s Republic of China. Ten milligrams per kilogram of HA-Gd2 О 3 NPs filtering through sterilized membrane filters (pore size 0.22 μm) were intravenously injected into the animals, then immediately investigated with a MRI scanner. These samples for MR imaging in vitro and animals in vivo were imaged with the following parameters:TR/TE =300/10 ms, 256 × 256 matrices, slices =5, thickness =2 mm, averages =2, FOV =80 × 80.
Radiosensitization Effect In Vitro
CCK-8 assay was used to evaluate radiosensitizing activity of HA-Gd2 О 3 NPs in vitro. Cells were seeded in five 96-well plates at a density of 3 × 10 3 cells/well, and each plate was treated at the same condition:cultured at 37 °C in 5% CO2 incubator for 24 h, then using DMEM containing different concentrations of HA-Gd2 О 3 NPs (0 μg/mL, 12.5 μg/mL, 25 μg/mL, 50 μg/mL, 100 μg/mL, and 200 μg/mL) replacing the growth medium. After incubation for 4 h, five plates were irradiated at different X-ray doses (0 Gy, 3 Gy, 6 Gy, and 9 Gy), 300 cGy/min, respectively. After radiation, all the plates were incubated for 4 h, then measuring the absorbance under the same parameters.
Clonogenic survival assay was also conducted to study the radiosensitization effect in vitro. HepG2 cells were seeded in six-well plates at 4.0 × 10 4 cells/well and allowed to grow for 16 h. The cells were incubated with HA-Gd2 О 3 NPs diluted in cell culture medium for 6 h. The cells were then irradiated at 6 Gy using a clinical linear accelerator (Oncor, Siemens, Germany) with 6 MeV irradiation using a 10 cm × 10 cm radiation field at a source-to-skin distance (SSD) of 100 cm to cover the entire cells. Then, these irradiated cells were allowed to grow for 14 days, fixed with 4% paraformaldehyde at room temperature for 40 min, stained with a 1% crystal violet after washing the cells.
Live-Dead Staining Assay and Flow Cytometry
To study the radiosensitization effect of HA-Gd2 О 3 NPs, HepG2 cells were seeded in six-well plates at a density of 4.0 × 10 4 cells/well and allowed to grow for 12 h and set six groups (control, HA-Gd2 О 3 NPs, radiation, radiation + 50 μg/mL HA-Gd2 О 3 NPs, radiation + 100 μg/mL HA-Gd2 О 3 NPs and radiation + 200 μg/mL HA-Gd2 О 3 NPs). When cells were grown to 80% in plates, the first group had no treatment, the second group was incubated with 100 μg/mL HA-Gd2 О 3 NPs for 24 h, the third group was just irradiated, and the fourth group to the sixth group were irradiated and incubated with different concentrations of HA-Gd2 О 3 NPs (50, 100, and 200 μg/mL) for 24 h, respectively. After that, FDA and PI working buffer were added for cell staining. The fluorescence of stained cells was observed under a fluorescence microscope (×20), and live cells showed green color and dead ones exhibited red color. Furthermore, cells by different treatments were washed three times with PBS, digested, collected, and centrifuged at a speed of 2000 rpm for 5 min, then fixed with 70% ethanol at − 20 °C overnight followed by PI staining. DNA fragmentation was quantified by the fluorescence intensity of PI on a flow cytometer (BD, Accuri, C6BD, Accuri, C6), analyzed by software (FLOWJO 7. 6. 2) to make clear the cell cycle distribution.
Radiosensitization Effect In Vivo
Female BALB/c mice with body weights of 19–21 g and ages of 6 weeks were obtained from the Yangzhou University Laboratory Animal Center under the standard conditions. Animal experiments were compliant with the Animal Management Rules of the Ministry of Health of the People’s Republic of China. A subcutaneous tumor model was established as the following procedures:First, 1 × 10 6 HepS cells were inoculated into mice intraperitoneal, and the ascites were collected after 5 days. Then, these ascites were injected into subcutaneous. When the tumor sizes reached approximately 100 mm 3 , subcutaneous tumors models were established and applied to the following experiments.
Eight mice bearing subcutaneous tumors per group were treated with radiation at 3 Gy per fraction to a total dose of 9 Gy within 7 days. The radiotherapy was conducted after 3 h intravenous injection of HA-Gd2 О 3 NPs (10 mg/Kg), on a Siemens Primus clinical linear accelerator (6 MeV) using a self-made device to cover the entire tumor. These mice were anesthetized by 1% pentobarbital (50 mg/kg) to assure immobility during irradiation. The volume was measured and recorded every day, determined from caliper measurement, and calculated by the formulae:V =0.5 × a × b 2 , where V (mm 3 ) is the volume of the tumor, and a (mm) and b (mm) are the tumor length and tumor width, respectively. Relative tumor volumes were normalized to their initial sizes. Each group was conducted on eight mice, wherein statistical analysis was performed using Student’s two-tailed t test (*p <0,05, ** p <0.001).
Доступность данных и материалов
The data sets supporting the results of this article are included within the article.
Наноматериалы
- Наночастицы золота для химиотерапевтических датчиков
- Наноалмазы для магнитных датчиков
- Наночастицы для терапии рака:текущий прогресс и проблемы
- Получение и магнитные свойства легированных кобальтом наночастиц шпинели FeMn2O4
- Перколяционный магнетизм в сегнетоэлектрических наночастицах
- Эффекты взаимодействия в сборке магнитных наночастиц
- Повышенная стабильность магнитных наночастиц золота с помощью сополимера поли (4-стиролсульфоновой кислоты …
- Модифицированный гиперразветвленный полиглицерин как диспергатор для контроля размера и стабилизации нано…
- Синтез и эффективность in vitro покрытых полипирролом железо-платиновых наночастиц для фототермической терапии…
- Сравнение функционализации магнитных наночастиц Fe3O4 на основе фолиевой кислоты и пептида gH625 для усиления ин…



