Синтез и активность окисления CO 1D смешанного бинарного оксида CeO2-LaO x, нанесенного золотыми катализаторами
Аннотация
Одномерные (1D) наностержни Ce-La с различным содержанием La (Ce и La в молярном соотношении 1:0, 3:1, 1:1, 1:3 и 0:1) были синтезированы гидротермальным способом. Наностержневые катализаторы Au / Ce-La были получены модифицированным методом осаждения-осаждения. Образцы характеризовались N 2 адсорбция-десорбция (BET), ICP, дифракция рентгеновских лучей (XRD), SEM, TEM, EDX, рентгеновская фотоэлектронная спектроскопия (XPS), УФ-видимая спектроскопия диффузного отражения (UV-vis DRS) и восстановление с программированием температуры (H 2 -TPR). Выяснилось, что Ла существует как ЛаО x в 1D наностержнях. Результаты катализа показали, что смешанные бинарные оксиды наностержней Ce-La могут быть хорошей подложкой для золотых катализаторов. Содержание La имеет важное влияние на каталитические характеристики наностержневых катализаторов Au / Ce-La. Среди катализаторов, когда молярное соотношение Ce / La составляло 3:1, 1,0% Au / Ce 0,75 -La 0,25 наностержни, предварительно обработанные при 300 ° C, показали лучшую активность среди катализаторов окисления CO, которые могут полностью преобразовать CO при 30 ° C. Катализаторы также показали высокую термостойкость и хорошую стабильность в отношении окисления CO при температурах реакции 40, 70 и 200 ° C.
Фон
Как очень вредный газ, CO может прочно связываться с атомом железа в гемоглобине крови, препятствуя выделению кислорода. Таким образом, его присутствие в помещении может даже привести к гибели людей и животных за короткое время. Проблема загрязнения воздуха становится все более серьезной. Каталитическое окисление CO было одним из наиболее эффективных решений для удаления CO для решения такой серьезной экологической проблемы [1,2,3,4,5,6,7,8]. В последнее время он также привлек большое внимание научного сообщества в области устройств контроля загрязнения для очистки выхлопных газов транспортных средств, очистки воздуха в помещениях и низкотемпературных датчиков CO [6,7,8,9,10]. Во многих случаях драгоценное золото диспергировано на определенных оксидах металлов с высокой способностью накапливать кислород, таких как CeO 2 , TiO 2 , и Fe 2 О 3 являются высокоэффективными кандидатами на окисление CO [11,12,13]. За последние десятилетия исследования нанесенных золотых катализаторов окисления CO при низких температурах привели к неожиданным наблюдениям. Принято считать, что каталитическая активность катализаторов Au сильно зависит от природы наночастиц Au и свойств носителей, таких как размер частиц золота, взаимодействие металла Au с носителем и восстанавливаемость носителя [14,15,16 , 17,18].
Как один из наиболее важных оксидов редкоземельных элементов, CeO 2 широко используется в трехкомпонентных катализаторах в качестве эффективного носителя катализатора благодаря своим уникальным физическим и химическим свойствам [6, 8, 15, 17]. Генеральный директор 2 обладает отличной способностью накапливать и выделять кислород благодаря способности переключать Ce 4+ / Ce 3+ , что делает CeO 2 стать активным оксидным компонентом различных катализаторов окисления, используемых в различных окислительно-восстановительных каталитических реакциях [17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32]. Площадь поверхности, мезопористые структуры, дефекты решетки и синергетические эффекты с другими легирующими добавками могут способствовать каталитическим свойствам наноматериалов церия [3, 22]. Для дальнейшего повышения производительности Au-CeO 2 катализаторов реакции окисления CO, многие стратегии были опробованы, такие как методы получения, включая соосаждение осаждением-осаждением, соосаждение и соосаждение с гелеобразованием мочевины, которые также использовались для контроля и оптимизации взаимодействия структуры Au-O-Ce, а также как размер и форма церия [33,34,35]. Были также предприняты попытки модификации поверхности опоры [4, 5, 22, 24, 26, 36,37,38]. Было обнаружено, что использование бинарных смешанных оксидов в качестве носителя может обеспечить хорошее решение для стабилизации наночастиц золота. Кроме того, промотирование благородным или переходным металлом увеличивает восстанавливаемость оксида церия и способствует образованию поверхностных кислородных вакансий. Между тем, легирование катионами переходных металлов оказалось эффективным методом улучшения физико-химических свойств одномерных (1D) наноструктурированных наноматериалов, таких как каталитическая активность [38,39,40]. Wang et al. [5] модифицировали поверхность Au / CeO 2 . с высокодисперсным CoO x и продемонстрировал превосходную каталитическую активность при низкотемпературном окислении CO. Ma et al. [37] сообщили, что CaO, NiO, ZnO, Ga 2 О 3 , Y 2 О 3 , ZrO 2 , а добавки редкоземельных элементов к катализатору золото-диоксид титана полезны для окисления CO, а легированные катализаторы могут проявлять значительную активность при температуре окружающей среды после старения при 500 ° C. Park et al. [38] сообщили, что главный исполнительный директор x модифицированный TiO 2 носитель является хорошим катализатором реакции конверсии водяного газа. Было проведено множество исследований смешанных оксидов металлов для каталитического окисления CO. Эти легированные ионы металла либо осаждаются на поверхности носителя в виде частиц оксида, либо в решетке носителя, которая не может образовывать отдельную оксидную фазу. Целью данного исследования является получение одномерных бинарных наностержней Ce-La, которые не являются перовскитом или смешанным оксидом твердого раствора. То есть в структуре одномерных наностержней два оксида металлов сосуществуют, сочетая достоинства двух составов для максимального синергетического эффекта. В связи с потенциальными технологическими возможностями применения в последние годы большое количество одномерных наноматериалов, включая наностержни, нанопроволоки и нанотрубки, были широко исследованы [2, 4, 41, 42]. Эти одномерные наноструктурированные материалы, особенно одномерные наностержневые материалы, были изучены в качестве важных опор или активных компонентов в области катализа, оптики и электрохимии, таких как хорошо контролируемые кремниевые нанопроволоки, используемые в солнечных элементах [42]. Было обнаружено, что свойства материалов с одномерной структурой, такие как каталитическая активность, часто тесно связаны с их кристаллической структурой и формой. Как следствие, разработка одномерных наностержневых материалов для адаптации их электронных и каталитических свойств оказалась интригующей и ценной.
Здесь мы сообщаем о простой сольвотермической стратегии для приготовления серии смешанных композитов с наностержнями Ce-La. В процессе синтеза LaO x и главный исполнительный директор 2 могли срастаться в один стержень. На морфологию конечных продуктов это не повлияло. Результаты XRD и TEM показывают, что катионы La существовали в форме LaO x . Было обнаружено, что легирующая добавка LaO x показали положительное влияние на активность золото-цериевых катализаторов. Au / Ce 0,25 -La 0,75 наностержни проявляют превосходную каталитическую активность в окислении CO.
Экспериментальный
Все химические вещества в этой статье были аналитической степени чистоты и использовались в том виде, в котором они были получены, без какой-либо очистки.
Подготовка к поддержке
Наностержни Ce-La были синтезированы традиционным гидротермальным методом. В типичном синтезе растворы NaOH (9 моль / л) и Ln (NO 3 ) 3 (Ln =Ce, La, 0,8 моль / л) смешивали и поддерживали интенсивное перемешивание в течение 30 мин при комнатной температуре. Полученную суспензию выливали в автоклав из нержавеющей стали с тефлоновым покрытием. Автоклав герметично закрывали и выдерживали при 110 ° C в течение 14 ч, а затем охлаждали воздухом до комнатной температуры. Полученные продукты фильтровали, промывали деионизированной водой и абсолютным спиртом, сушили при 80 ° C в течение 12 часов, а затем прокаливали при 400 ° C на воздухе со скоростью нагрева 5 ° C мин -1 . перед нанесением наночастиц золота. Конечные продукты с различным содержанием La (Ce и La в молярном соотношении 1:0, 3:1, 1:1, 1:3 и 0:1) были обозначены как наностержни Ce, Ce 0,75 -La 0,25 наностержни, Ce 0.50 -La 0.50 наностержни, Ce 0,25 -La 0,75 наностержни и наностержни La.
Подготовка катализатора
Процесс осаждения-осаждения был проведен для приготовления наностержневых катализаторов Au / Ce-La. Вкратце, необходимое количество наностержней Ce-La было диспергировано в 100 мл деионизированной воды, а затем смешано с определенным количеством 0,01 моль / л HAuCl 4 . решение. В качестве pH конечного HAuCl 4 раствор был около 7, что было связано с основностью носителя и кислотностью HAuCl 4 , pH раствора не регулируется. Суспензию перемешивали 12 ч и кипятили при 100 ° C 4 ч. После процедуры осаждения-осаждения осадок центрифугировали, промывали водой для удаления Cl - ионы и сушили при 80 ° C на воздухе в течение 12 ч. Концентрации золота выражались в процентах от массового содержания.
Методы характеризации
Содержание золота в наностержневых катализаторах Au / Ce-La определяли с помощью атомно-эмиссионной спектроскопии с индуктивно связанной плазмой (ICP-9000, USA Thermo Jarrell – Ash Corp). Площадь поверхности Брунауэра-Эммета-Теллера (БЭТ) образцов наностержней Ce-La измеряли по адсорбции азота при -196 ° C с использованием прибора Micromeritics Tristar II 3020. Рентгеноструктурное исследование проводили на рентгеновском дифрактометре Rigaku D / Max-2500 ( Kα λ =0,154 нм) в 2 θ диапазон 3–80 °. УФ-видимый DRS катализаторов собирали на спектрофотометре UV-Vis NIR (JASCO Corp V-570). Наблюдения с помощью просвечивающего электронного микроскопа и энергодисперсионного рентгеновского анализа (EDX) были получены с помощью просвечивающего электронного микроскопа JEM-2100, работающего при 200 кВ. Данные СЭМ и изображения отображения элементов были получены с помощью растрового электронного микроскопа JSM-7500F, работающего при 15 кВ. XPS записывали для определения химического состава и степени окисления катализаторов на рентгеновском фотоэлектронном спектрометре Kratos Axis Ultra DLD с использованием монохроматизированного Al Kα источник работал при 150 Вт. Энергии связи были откалиброваны с использованием C 1 s пик расположен при 284,6 эВ. Снижение с программированием температуры (H 2 –TPR) был выполнен на приборе PX200 для измерения H 2 потребление. До H 2 -TPR анализ, образцы предварительно обрабатывали в потоке He при 300 ° C в течение 1 ч. После охлаждения до 50 ° C катализатор восстанавливали 10 об.% H 2 . / Поток газа Ar при нагревании до 900 ° C со скоростью 10 ° C / мин.
Тест каталитической активности
Оценку каталитической активности проводили в миллиреакторе с неподвижным слоем потока с внутренним диаметром 8 мм. Перед реакцией 200 мг катализатора разбавляли 17,6 г химически инертного кварцевого песка. Затем в реактор вводили смесь 10% CO, уравновешенную воздухом, с общим расходом 36,3 мл мин -1 . . После выдержки при температуре реакции в течение 30 минут газообразные продукты анализировали в режиме онлайн с помощью CO x анализатор (газовая хроматография GC-508A). Конверсия CO рассчитывалась по следующему уравнению:
$$ \ mathrm {CO} \ kern0.5em \ mathrm {conversion} =\ frac {\ left [\ mathrm {CO} \ 2 \ right]} {\ left [\ mathrm {CO} \ right] + \ left [ \ mathrm {CO} \ 2 \ right]} \ times 100 \% $$где [CO] и [CO 2 ] представляют выход CO и CO 2 концентрации соответственно. Температурную зависимость каталитической активности образца регистрировали в диапазоне 30–200 ° C со скоростью нарастания 10 ° C мин −1 . .
Результаты и обсуждение
Характеристика наностержневых катализаторов Au / Ce-La
ICP
Количество золота, присутствующего в наностержневых катализаторах Au / Ce-La, определяли методом ICP-AES. Результаты, представленные в таблице 1, показали, что фактическое количество золота во всех катализаторах было ниже номинального. Согласно методике подготовки, золото должно теряться в процессе осаждения-осаждения.
СТАВКА
N 2 измерения поглощения использовались для измерения площади поверхности по БЭТ и среднего диаметра как CeO 2 наностержни и нанокомпозиты Ce-La. Как показано на рис. 1, изотермы адсорбции для наностержней Ce-La относятся к типу IV и демонстрируют характеристики петель гистерезиса H3. Все образцы показывают очень сильное увеличение N 2 -адсорбированный объем при относительном давлении выше 0,85, что является характеристикой присутствия значительного количества мезопористых частиц [2, 22], что указывает на нанокомпозиты Ce-La, состоящие из агрегатов (рыхлых скоплений), образующих щелевидные поры. С добавкой La петли гистерезиса сдвинулись до относительного давления около 0,95, что означало, что размер пор станет меньше, что соответствует уменьшению композитов Ce-La. Как показано в таблице 2, удельная поверхность CeO 2 наностержни 99,7 м 2 / г, что уменьшается до 74,1 м 2 / г, когда La легирован с молярным соотношением Ce / La 3:1. С увеличением содержания La площадь поверхности нанокомпозитов Ce-La непрерывно уменьшалась. В основном это происходит из-за содержания La, которое не встраивается в решетку CeO 2 . и существовать как изолированный LaO x что приводит к небольшому различию в морфологии нанокомпозитов Ce-La. Можно было заметить, что все наностержни имеют одинаковую площадь поверхности 80–100 м 2 . /г. Объем пор Ce 0,75 -La 0,25 наностержни 0,23 см 3 / г, что было похоже на наностержни Ce и больше, чем у других наностержней Ce-La. Расчетные диаметры пор на основе анализа BJH подтвердили мезопористую природу нанокомпозитов Ce-La. Это может быть преимуществом для каталитического окисления CO.
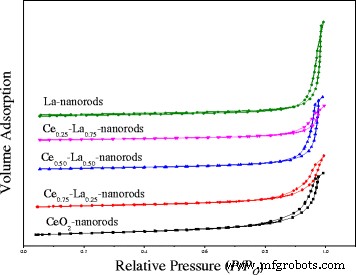
Изотермы адсорбции-десорбции азота наностержней Ce-La с различным содержанием La
XRD
Синтезированные образцы были подвергнуты порошковому рентгеноструктурному анализу, а их структурные характеристики были впоследствии проанализированы. Пики кристалличности оксида церия (рис. 2а) наблюдались при 2θ =28,6 °, 33,1 °, 47,6 ° и 56,3 °, соответствующих плоскостям дифракции (111), (200), (220) и (311) и подтверждают кубическую структуру флюорита CeO 2 кристалл (JCPDS № 34-0394). При содержании La 0,25 ат.% Дифракционные пики композитов La-Ce уширяются. Пики с центрами при 2θ =30,0 °, 46,0 °, 52,0 ° и 53,6 ° соответствуют плоскостям дифракции изолированного La 2 . О 3 . La (OH) 3 не отнесены к пикам может быть обнаружен. Но из-за низкого содержания и приблизительного положения дифракции определить наличие LaO x нелегко. . С увеличением содержания La наблюдаются некоторые заметные пики для La 2 . О 3 или La (OH) 3 в нанокомпозите. Основные дифракционные пики La 2 О 3 присутствуют при 2θ =30,0 ° (101), 39,6 ° (220), 46,2 ° (110) и 66,8 ° (112), что может быть отнесено к гексагональной фазе (карта JCPDS 05-0602). Основные дифракционные пики La (OH) 3 присутствуют при 2θ =15,7 ° (100), 27,3 ° (110), 27,9 ° (101) и 39,4 ° (201), что может быть отнесено к гексагональной фазе (карта JCPDS 36-1481). Результаты показывают, что La может существовать как изолированный La 2 . О 3 или La (OH) 3 в композите. После осаждения золота не было дифракционного пика, который можно было бы отнести к чистой гранецентрированной кристаллической структуре золота (рис. 2b). Это может быть связано с низким содержанием и / или малым размером частиц наночастиц золота.
Рентгенограммы наностержней 1% Au / Ce-La с различным содержанием La (0–100 ат.%) ( a ) и Au / Ce 0,75 -La 0,25 наностержни с различным содержанием золота, прокаленные при 300 ° C в течение 2 ч ( b )
SEM и TEM
На рис. 3a – e показаны фотографии CeO 2 , полученные с помощью СЭМ. и нанокомпозиты Ce-La, полученные при различной концентрации La 3+ ионы. Видно, что все нанокомпозиты Ce-La имеют стержнеобразную структуру. Очевидно, что многие стержни складываются в пучки Ce-La, что приводит к образованию щелевидных пор разного размера. Результаты согласуются с N 2 изотермы адсорбции-десорбции. Как показано на рис. 2а, продукт в основном состоит из наностержней диаметром 5–10 нм и длиной 100–300 нм. На рис. 3e отчетливо видно большое количество наностержней диаметром около 12,5 нм, а также небольшое количество коротких наностержней со средним диаметром около 8,0 нм. На рис. 3б – г при увеличении концентрации легирования La 3+ , образцы всегда имеют морфологию наностержней. Однако, хотя концентрация легирования составляла 25 мол.%, Образцы в исходном состоянии демонстрировали наиболее однородные наностержни диаметром 5–20 нм и длиной 100–300 нм среди всех образцов. На рис. 3е представлены ПЭМ-изображения полученных индивидуальных наностержней Ce-La. Как видно из изотерм адсорбции-десорбции азота, видно, что в носителе имеется много пор. ПЭМ-изображение наностержней Ce-La показало, что они структурно однородны и имеют монокристаллическую природу. Полосы решетки на вставке на рис. 3f иллюстрируют два значения межплоскостного расстояния, то есть 0,31 и 0,34 нм, которые согласуются с плоскостями (111), (110) CeO 2 и La 2 О 3 соответственно [3, 15, 43]. Выяснилось, что La 3+ ионы эффективно генерируются в La 2 О 3 , что согласуется со спектром XRD.

СЭМ-изображения наностержней Ce-La с различным содержанием La:0 ( a ), 25 ат.% ( b ), 50 ат.% ( c ), 75 ат.% ( d ), 100 ат.% ( e ); ПЭМ изображение Ce 0.50 -La 0.50 наностержни ( f ); а на вставке показано соответствующее изображение HRTEM
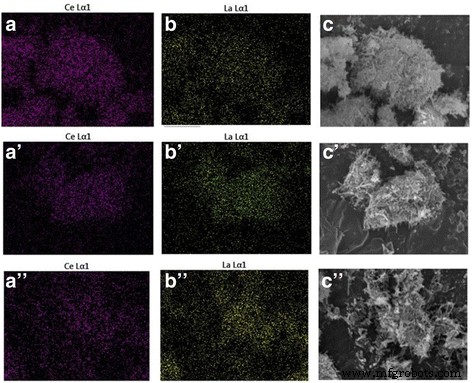
Для определения химического состава образцов Ce-La использовались элементное картирование и EDS-анализ (рис. 4 и таблица 3). Результаты показали однородные молярные отношения La / Ce, хорошо согласующиеся с ожидаемыми значениями, полученными при синтезе. ПЭМ-изображения Au / Ce 0,75 -La 0,25 Образцы, прокаленные при 300 ° C (рис. 5a) и 400 ° C (рис. 5c), ясно показали, что форма нанокристаллов Ce-La практически не изменилась после добавления золота. С помощью просвечивающей электронной микроскопии на наностержнях Ce-La частицы золота не наблюдались. Наличие очень высокодисперсных кластеров золота ( d <1 нм) было подтверждено картированием элементов и анализом EDX (вставка на рис. 5b, e и f). В соответствии с этим, рентгеноструктурный анализ, выполненный на этом образце (рис. 2), не выявил пиков, связанных с золотом, из-за того, что частицы золота слишком малы, чтобы их можно было обнаружить. Это указывает на то, что поверхности наностержней Ce-La могут диспергировать и стабилизировать атомы золота в виде субнанометровых кластеров (невидимый ПЭМ). Это согласуется с литературными данными [2, 44,45,46]. Однако некоторые крупные агломераты золотых частиц (в среднем d ~ 7 нм) наблюдались в Au / Ce 0,75 -La 0,25 наностержни, прокаленные при 400 ° C, из-за того, что полосы с расстоянием 0,236 нм отнесены к плоскости (1 1 1) металлического Au (рис. 5c, на котором показан агломерат частиц золота). Видно, что при высокой температуре прокаливания частицы золота явно росли, что, соответственно, приводило к потере каталитической активности.

Картирование элементов изображения Ce и La, SEM-изображения смешанных образцов для наностержней Ce-La с содержанием La 25 ат.% ( a - c ), 50 ат.% ( a ′ - c ′), 75 ат.% ( a ′ ′ - c ″)
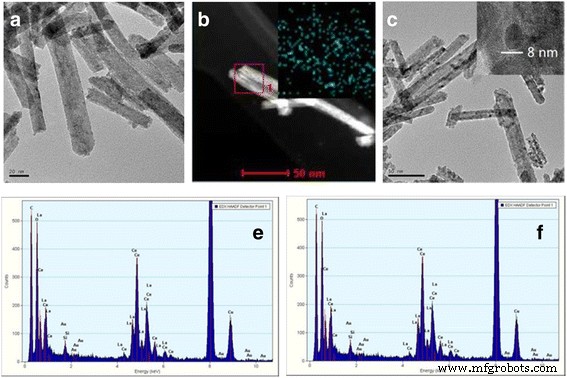
ПЭМ- и СТЭМ-изображения 0,5% Au / Ce 0,75 -La 0,25 наностержни, прокаленные при 300 ° C ( a - б ) и 400 ° C ( c ), EDX-анализ ( e - е ) изображений ( a - б ), что указывает на наличие сигнала Au
XPS
Спектры РФЭС на рис. 6 выполнены для исследования химического композита и состояний в 1% Au / Ce 0,75 -La 0,25 образцы наностержней прокаливали при 300 ° C в течение 2 ч. Спектр РФЭС Ce 3 d показывает отчетливые пики 3 d 3/2 спин-орбитальные состояния и 3 d 5/2 спин-орбитальные состояния на рис. 6а. Как известно, пики расположены при энергии связи около 899, 903 и 916 эВ, которые обычно используются в качестве спектроскопического маркера для обнаружения присутствия Ce 4+ . государство. В нашем случае Ce 3 d уровни ядра показывают три спин-орбитальных дублета, которые являются характерными пиками для четырехвалентных состояний Ce 4+ . Пики, расположенные около 882,8, 888,1 и 898,4 эВ, относятся к Ce 3 d 5/2 , а около 901,3, 907,0 и 916,7 эВ относятся к Ce 3 d 3/2 , соответствующие спин-орбитальным расщепленным дублетам соединений Ce (IV). Наблюдаемые результаты в целом совпадают с опубликованными в литературе [19, 28, 29, 32]. Очевидно, что образцы находятся в состоянии Ce 4+ без примеси Ce 3+ государство. На рисунке 6b показаны XPS-спектры La 3 d область 1% Au / Ce 0,75 -La 0,25 образцы наностержней. И спин-орбита разделена на 3 d 5/2 и 3 д 3/2 уровни показали двухпиковые структуры. Спин-орбитальное расщепление между 3 d 3/2 и 3 д 5/2 Уровни были около 17,0 эВ, а расстояние между спутником и основным пиком составляло 4,1 эВ, что соответствовало заявленным значениям для La 3+ соединения [11, 47]. Как и следовало ожидать, La находится в степени окисления +3 и может иметь важное влияние на каталитическую активность. О 1 s Спектр XPS (рис. 6c) асимметричен и деконволюционирован до 529,3, 531,6 и 527,6 эВ соответственно. Пик при 529,3 эВ соответствует решеточному кислороду, а пик при 531,9 эВ - гидроксильным группам на поверхности носителя [27, 28, 32]. Небольшой пик на плече при 527,6 эВ приписывается La-O, который также может указывать на присутствие LaO x в катализаторах [11, 48]. Очевидно, что на поверхности носителя имеется большое количество гидроксильных групп в соответствии с высокой интенсивностью пика. Спектры РФЭС в Au 4 f Области катализаторов, прокаленных при 300 и 400 ° C, показаны на рис. 6d. На рис. 6d катализаторы, прокаленные при 300 ° C, показали Au 4 f 7/2 сигналы энергии связи при 84,6 эВ. Сигналы были характерны для катионного Au + виды [14, 15, 31]. Для сравнения, после прокаливания катализаторов при 400 ° C Au 4 f 7/2 пик располагался при энергии связи 83,6 эВ, а Au 4 f 5/2 находился при энергии связи 87,7 эВ. Наличие металлического Au 0 четко наблюдается. Также были обнаружены небольшие пики, расположенные около 85,0 и 88,2 эВ, соответствующие окисленным частицам золота. Ясно, что катализаторы, прокаленные при 300 ° C, показали практически в основном катионный Au + . виды (> 90% Au + разновидность). Напротив, образцы, прокаленные при 400 ° C, содержат 90% Au 0 . и 10% Au δ + . Перенос электронной плотности от металлического Au к носителю приводил к частичному окислению Au и сильному взаимодействию между золотом и носителем. Наличие Au δ + отвечает за частичное уменьшение опорной поверхности. Соответственно, Au δ + считается более активным, чем Au 0 для окисления СО [11, 21]. В нашем случае катализаторы, прокаленные при 300 ° C, имели больше Au δ + чем катализатор, прокаленный при 400 ° C, поэтому нетрудно сделать вывод, что катализаторы, прокаленные при 300 ° C, были более активными, чем катализаторы, прокаленные при 400 ° C, что согласуется с результатами активности.
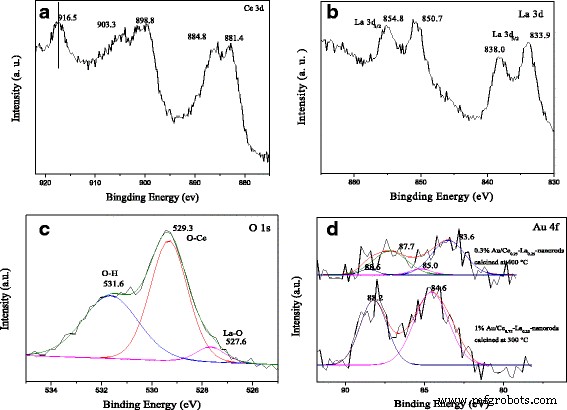
XPS-спектры 1% Au / Ce 0,75 -La 0,25 наностержни, прокаленные при 300 ° C в течение 2 ч:Ce 3 d пики ( a ), Ла 3 d пики ( b ) и O 1 s пики ( c ). Au 4 f пики ( d ) Au / Ce 0,75 -La 0,25 наностержни, прокаленные при 300 и 400 ° C в течение 2 ч
Видно в ультрафиолетовом свете
Спектр диффузного отражения в УФ и видимой областях Ce 0,75 -La 0,25 наностержни и 0,5% Au / Ce 0,75 -La 0,25 наностержни, прокаленные при различных температурах, представлены на рис. 7. Как видно на этом рисунке, по сравнению со спектрами носителя спектры катализаторов, прокаленных при разных температурах, демонстрируют слабую и широкую полосу поглощения между 500 и 600 нм, которая характерна для поверхностный плазмонный резонанс (ППР) наночастиц металлического золота [21, 24, 49]. ППР можно было бы приписать коллективным колебаниям электронов в ответ на оптическое возбуждение, которое привело бы к поглощению света в УФ-видимой области. На расположение поверхностного плазмонного резонанса влияли размер диспергированных частиц золота, форма частицы и диэлектрические свойства окружающего материала. В настоящем исследовании предварительная обработка прокаливанием вызвала большое красное смещение полос поглощения, а положения полос поглощения (500-600 нм) были смещены в красную область при повышении температуры прокаливания. Уровни смены следующие:80 ° C → 200 ° C → 300 ° C. При дальнейшем повышении температуры прокаливания до 400 ° C полосы поглощения смещались в коротковолновую область. Было несколько сообщений об объяснении смещения положения пика [24, 50, 51, 52, 53]. Хотя диаметр золотых частиц составляет <2 нм, расширенное положение пика сдвига в основном вызвано зависящим от размера демпфированием диэлектрической функции металла. Также произошло снижение электронной плотности в золотых частицах из-за химического взаимодействия с окружающими оксидами металлов, что могло бы объяснить механизм, приводящий к дальнейшему красному смещению [52]. Увеличение размера золотых частиц вызовет синий сдвиг пика поглощения (средний диаметр меньше 25 нм), а для крупных частиц (средний диаметр больше 25 нм) наблюдается противоположный эффект [53]. По данным ПЭМ размер частиц золота в катализаторе был <1 нм для катализатора, прокаленного при 300 ° C. Однако при дальнейшем повышении температуры прокаливания до 400 ° C частицы золота росли, и средний размер составлял около 7 нм. Как упоминалось ранее, положение плазмонной полосы сильно зависело от формы и размера частиц золота. В данном случае этот большой сдвиг можно объяснить разницей в размерах частиц золота. Данные согласуются с результатами теста каталитической активности. Это также указывало на то, что наночастицы золота хорошо диспергировались на поверхности подложек.
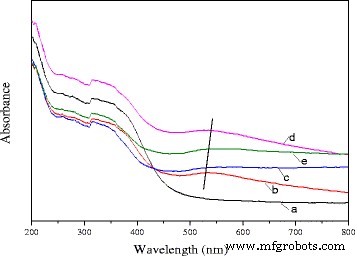
УФ-видимый DRS чистого Ce 0,75 -La 0,25 подложка для наностержней (а) и 0,3% Au / Ce 0,75 -La 0,25 наностержни, кальцинированные при 80 ° C (б), 200 ° C (в), 300 ° C (г) и 400 ° C (д)
H 2 -TPR
На рис. 8а показан профиль ТПВ для образцов чистого и смешанного оксидов. Для чистого CeO 2 наностержней, пик восстановления с центром примерно при низкой температуре (410 ° C) и высокой температуре (620 ° C) можно отнести к восстановлению поверхностных и объемных форм кислорода CeO 2 соответственно [1, 32]. Для наностержней чистого La очевидные пики восстановления могут быть обнаружены при ~ 700 ° C, относящиеся к восстановлению объемного La 2 О 3 . Интересно было обнаружить появление пиков восстановления наностержней Ce-La при ~ 500 ° C. Пик восстановления трех образцов с 25, 50 и 75% ат.% Легирования La показывает сдвиг в сторону более высокой температуры примерно на 20 ° C после легирования La. Когда содержание La составляет 25 ат.%, Наблюдалась пиковая температура сильного восстановления 520 ° C. Это новая температура восстановления, значительно отличающаяся от температуры чистого CeO 2 . наностержни. По сравнению с эталоном, из-за синергетического взаимодействия между La – O и Ce – O, температура восстановления наностержней Ce-La была выше, чем у чистого CeO 2 [31, 54]. Было обнаружено, что бинарные оксиды должны иметь независимый CeO 2 и ЛаО x . Как показано на рис. 8b, после осаждения золота для Au / CeO 2 появляется новый пик восстановления при очень низкой температуре (100–200 ° C). и наностержни Au / La-Ce. Здесь, согласно результатам XPS, после прокаливания катализаторов при 300 ° C Au в основном представлял собой Au δ + , поэтому пики восстановления при ~ 200 ° C приписывают восстановлению частиц Au с высокой валентностью [21]. Небольшой пик с центром при ~ 350 ° C может быть связан с восстановлением наностержней Ce-La. Кроме того, для 1% Au / Ce 0,75 -La 0,25 наностержни, другой пик восстановления при температуре около 230 ° C может быть приписан восстановлению CeO 2 с помощью золота. . Один процент Au / Ce 0,75 -La 0,25 наностержни имеют самую низкую температуру восстановления среди катализаторов, что может помочь им стать наиболее активным катализатором окисления CO. This was in agreement with the activity results. Since the surface reduction peaks for all oxide supports are significantly decreased after gold deposition, it indicates that most available oxygen is reduced at this lower temperature and suggests that H2 dissociation on gold and spill-over onto the adjacent oxide surface are more likely to be responsible for the strong low-temperature reduction peak [31]. TEM and XPS data indicated that the cationic gold particles with small size highly dispersed on the surface of the supports. The presence of LaO x could also help stabilize cationic Au. This is beneficial for the strength of gold-support interaction [11]. The strong interaction between gold and support promoted the reduction of Au/Ce-La nanorods shifted to low temperature. The results indicated that the reducibility of Ce-La nanorods is strongly affected by the gold deposition.
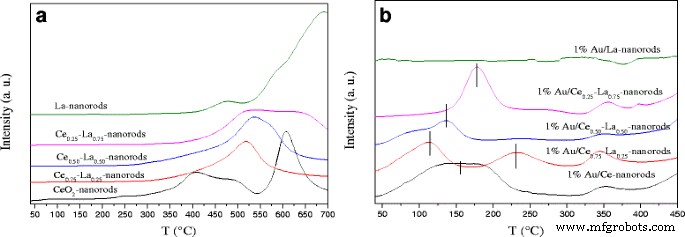
H 2 -TPR profiles of a La-Ce nanorods with different La content (0–100 at.%) and b 1% Au/La-Ce nanorods with different La content calcined at 300 °C
Catalytic Activity
Effect of La Content
As shown in Fig. 9, catalytic activity results for Au/Ce-La nanorod samples ranging from pure CeO2 to 100 at.% La-content nanorod supports. The most striking feature in the figure is the high activity of the Au/Ce0.75 -La0.25 nanorod catalyst with the 100% conversion at temperature as low as 30 °C. In contrast, the other Au/La-Ce catalysts showed lower activity compared to Au/Ce0.75 -La0.25 nanorods catalysts under the same reaction conditions. The results indicated that La doping has very much impact on this high CO conversion activity with a La content of 25 at.%, while a further increase results in a significant drop in activity. This again closely mirrors the trends seen in the reducibility of the samples, where an increase of La content from 25 at.% results in a strong loss of reducibility.
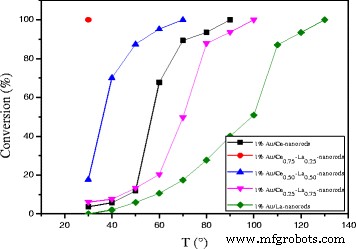
Catalytic activities of 1% Au/ La-Ce nanorods with different La content calcined at 300 °C for 2 h
In consideration of the preparation methods, gold loadings, gold particle size and distribution on different Ce-La nanorods supports, XRD, TEM and XPS data showed that all the catalysts should have the same number and type of active Au sites. So this high activity of the Au/Ce0.75 -La0.25 nanorods catalysts correlates well with the reducibility data discussed above. H 2 -TPR results indicated that Au/Ce0.75 -La0.25 nanorods has the lowest reducibility temperature and highest reducibility in the region of 50–400 °C, especially in the region of 50–150 °C, which could exactly approach the region of reaction temperature. In the process of reaction, the Ce0.75 -La0.25 nanorod support served as oxygen carrier. The reducibility of Ce0.75 -La0.25 nanorods could promote the formation of active oxygen. That is to say high reducibility of the catalyst, good activity the catalyst has. Au/Ce0.75 -La0.25 nanorod catalyst subsequently has the best activity.
Effect of Gold Content
The catalytic activities for CO oxidation were measured from low conversion to 100% conversion for the Au/Ce0.75 -La0.25 nanorod catalysts calcined at 300 °C for 2 h with a series of low gold contents. As shown in Fig. 10, all of the catalysts showed high catalytic activities. The CO conversion increased greatly with increasing gold content. The complete CO conversion could be attained at 50 °C over 0.5% Au/Ce0.75 -La0.25 nanorod catalyst. The size and chemical states of gold nanoparticles are generally thought to be vital for the performance of supported gold catalysts. It has been reported that its gold nanoparticles with the diameter of < 5 nm would be suitable for the supported gold catalysts in the catalytic CO oxidation [27, 28]. The XPS data proved that gold in Au/Ce0.75 -La0.25 nanorod catalyst exists in the form of cationic Au + . TEM images of the samples were also shown to investigate the diameter of gold nanoparticles in the catalysts. Consequently, the gold particles of Au/Ce0.75 -La0.25 nanorods were detected as sub-nanometer. Taking into account the particle size, mass content, and chemical states of the gold nanoparticles, gold particles with small diameter highly dispersed on the surface of Ce0.75 -La0.25 nanorods and interacted strongly with the support [17, 21, 23]. The strong interaction between gold particles and the support would help improve CO adsorption and accelerate active oxygen spillover to gold particles from the support, so 0.5% Au/Ce0.75 -La0.25 nanorods which had relatively high content of gold should exhibit the best CO oxidation activity. In fact, 0.5% Au/Ce0.75 -La0.25 nanorods indeed present high performance. The results demonstrated the activity of supported gold catalysts is strongly dependent on the gold nanoparticle size, chemical states, and the quantity of the active species, an increase of which implied an increase of the catalytic activity. In the case of Au/Ce0.75 -La0.25 nanorod catalyst, catalysts with low gold content could also exhibits high activity at low temperature, which would promote the progress of supported gold catalyst. The results indicated that supported gold catalysts prepared by deposition-precipitation with pH value of 6–10 for HAuCl4 solution could have high catalytic activity due to small diameter of gold nanoparticles, corresponding with the references [8,9,10].
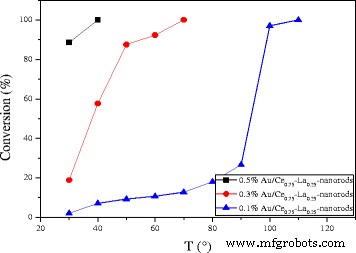
Catalytic activities of Au/Ce0.75 -La0.25 nanorods with different gold goadings calcined at 300 °C for 2 h
Effect of Calcination Temperature
The effect of calcination temperature on the catalytic activity of 0.5%Au/Ce0.75 -La0.25 nanorods is also shown in Fig. 11. The results indicated an increase in the activity of catalyst with the calcination temperature from 80 to 300 °C. The 0.5% Au/Ce0.75 -La0.25 nanorod catalyst calcined at 200 °C could convert CO to CO2 completely at 80 °C. While for 0.5% Au/Ce0.75 -La0.25 nanorod catalyst calcined at 80 °C, the temperature increased to 100 °C. The results showed that CO conversion increased with increasing calcinations temperature. Then, for the sample calcined at 400 °C, about 90% CO can be converted to CO2 at 100 °C and CO could be converted to CO2 completely at 120 °C. The sample calcined at 300 °C possessed the best catalytic activity. The catalytic performance of supported gold catalysts strongly depends on gold nanoparticle size and metal-support interaction due to “synergic effect” at the gold-support interface [10, 13, 15, 18]. The gold-support interaction largely depended on calcination temperature of catalysts. The electron could transfer from gold to the support [10]. Thus, with increasing calcination temperature, the charges on gold particles became increasingly positive, which is good for the enhancement of catalytic activity for CO oxidation. Here, as shown in the Fig. 5, size of gold particles in the catalysts calcined at 300 °C was small. The XPS data also indicated that gold was main Au δ+ after calcination at 300 °C. Thus, the stronger metal-support interaction could account for the relative good catalytic performance for catalysts calcined at 300 °C. From 80 to 300 °C, the higher the calcination temperature is, the stronger interaction exists between gold particles and support. As a consequence, from 80 to 300 °C, the activity of catalysts increased. However, after the 0.5% Au/Ce0.75 -La0.25 nanorod catalyst calcined at 400 °C, complete conversion temperature increased. The main reason might be that the high-temperature treatment led to increased mobility and growth of gold nanoparticles, which correspondingly led to the loss of catalytic activity. The XPS also suggested that the catalysts calcined at 400 °C, Au was mainly Au 0 . It could be concluded that the activities of supported gold nanoparticles were influenced by both the oxidation state and the size of gold nanoparticles, and the appropriate calcination temperature was 300 °C.
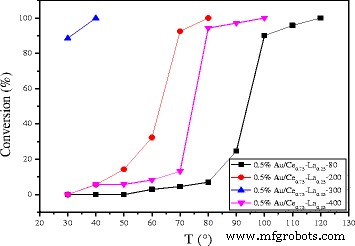
Catalytic activities of 0.5% Au/Ce0.75 -La0.25 nanorods calcined at different temperatures
Stability Observations
The stability of the 0.3% Au/Ce0.75 -La0.25 nanorod catalyst during CO oxidation at different reaction temperatures was measured, as shown in Fig. 12a. When the reaction was carried out at 70 °C, the initial CO conversion over 0.3% Au/Ce-La catalyst can reach 100% and has almost no change with continuously increasing reaction time. 0.3% Au/Ce-La catalyst with 60% CO conversion rate at 40 °C is also attained even after 10-h running period, and no obvious decline in CO conversion is observed. Although the catalytic activity of 0.3% Au/Ce0.75 -La0.25 nanorod catalyst at 40 °C was lower than that of 0.3% Au/Ce0.75 -La0.25 nanorod catalyst at 70 °C, the conversion of CO over the catalysts at both temperatures still seemed to be stable over 10 h on stream. It is thought that the catalyst was of good durability. It was clear that the activity over 0.3% Au/Ce0.75 -La0.25 nanorod catalyst did not strongly depend on the reaction temperature. As the reaction temperature decrease the activation rate barely becomes little slower and then finally reaching a steady state in which the CO conversion was still around 90%. For comparison, the stability of 0.5% Au/Ce0.75 -La0.25 nanorod catalyst at the reaction temperature of 40 °C with initial conversion of 100% was also provided in Fig. 12b. It was obvious that in 10 h, no decrease of CO conversion for 0.5% Au/Ce0.75 -La0.25 nanorods was detected. The results depicted that with the change of gold content, Au/Ce0.75 -La0.25 nanorods could still perform good stability.
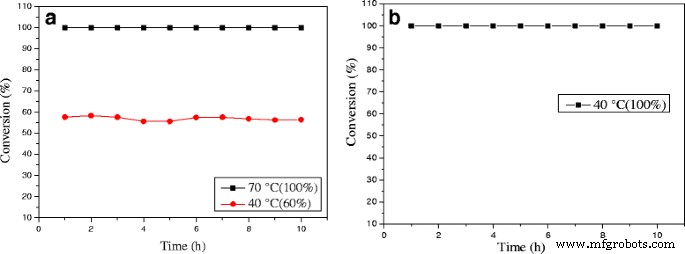
The stability of 0.3% Au/Ce0.75 -La0.25 nanorods, reaction temperature:40 and 70 °C (a ) and 0.5% Au/Ce0.75 -La0.25 nanorods, reaction temperature:40 °C (b ) for the CO oxidation
As engine efficiency increases and automotive exhaust temperatures decrease, traditional supported gold catalysts would be insufficient to meet emission regulations. And there are also a number of industrial catalytic processes which (e. g., the catalytic oxidation of CO in automotive exhaust gas) are sometimes carried out at high temperatures. Thus, the development of new catalysts that are active at lower temperature, yet still stable at periodic high temperatures, will be vital. In the two regards, catalysts with good activity at low temperature that are stable at high reaction temperatures are desirable. It is necessary to investigate their catalytic performance for CO oxidation at a certain high temperature which is a very stringent test for the stability of gold nanocatalysts against sintering. In the present work, the stability of 0.3% Au/Ce0.75 -La0.25 nanorod catalyst was also measured at 200 °C (100%) for high-temperature treatment. As shown in Fig. 13, no decline of catalytic activity was observed within 50 h indicates that the catalyst keeps good stability within 50 h. Remarkably, very few serious gold sintering occurred during the reaction. It indicated that 0.3% Au/Ce-La catalyst can exhibit good catalytic stability at both low and high reaction temperatures.
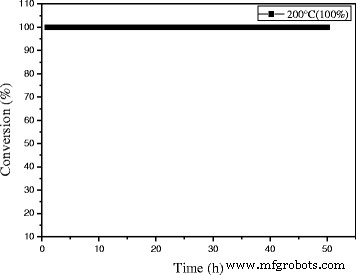
The stability of 0.3% Au/Ce0.75 -La0.25 nanorods at the reaction temperature of 200 °C for CO oxidation
Reaction Mechanism Speculate
Combined with H2 -TPR and XPS experiments, it suggested that CO oxidation over LaO x -doped CeO2 -supported Au catalysts might follow the Langmuir–Hinshelwood + Redox mechanism [1, 20, 26, 30, 32]. The XPS results suggest that there are Ce 3+ and Ce 4+ on the surface of the catalyst. H 2 -TPR data also proved that reducibility of this binary Ce-La nanorod oxides could be promoted by Au deposition. The reducibility of Au/Ce-La nanorods was much higher than pure Au/CeO2 or Au/LaO x catalysts. This would help the produce of oxygen vacancies. The oxygen vacancy is a very lively activity center. The active center can promote the activation of O2 . Thus, the CO oxidation reaction could become more easily. There are also amount of adsorbed oxygen species on the surface of catalyst. Usually adsorbed oxygen species play an important role in the oxidation of CO. The O2 of the reaction will form the chemisorbed oxygen, and the oxygen vacancy would be replenished by O2 of reaction gas to form new active lattice oxygen. XPS data also proved that gold in the catalysts was mainly Au δ+ species, which would accelerate the adsorption of CO. The possible reaction mechanisms of Au/Ce-La nanorod catalyst could be described as follows. Firstly, CO and O2 were chemisorbed on the surface of the catalysts. Then, the chemisorbed oxygen directly reacts with CO, or the active lattice oxygen of the catalyst reacts with CO, and the catalyst produced the oxygen vacancy with oxygen from gas-phase O2 . At last, CO was oxidized into CO2 (shown in Fig. 14).
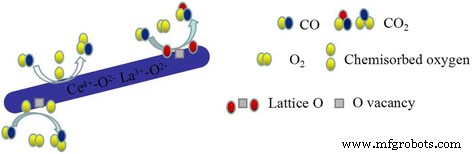
Proposed CO reaction pathways over the catalysts, Au/Ce-La nanorods
Conclusions
In summary, a series of mixed Ce-La nanorods with various amounts of La was prepared via a simple hydrothermal reaction at high concentration of NaOH and without surfactant. Gold was loaded by deposition-precipitation. After La doping, the composite could retain the initial rod morphology. As a result, Ce-La nanorods with 25 at.% La maintained the optimal nanorods with the length of 0.6 um and the diameter of 3–5 nm. Gold particles were dispersed well on the support. The reducibility of Ce-La nanorods could be affected significantly by LaO x doping. The deposition of gold had important influence on the reducibility of catalyst. Thus, the CO oxidation activity of Au/Ce-La nanorods was essentially changed in comparison with pure Au/CeO2 and Au/La nanorods. One percent Au/Ce0.75 -La0.25 nanorods could convert CO to CO2 completely at 30 °C. Further increase in La content results in decreased activity due to the decrease in reducible oxygen sites. The Au/Ce0.75 -La0.25 nanorod catalyst with low gold concentration also showed high activity. With the increase of gold content, there is an increase in the activity. The stability test of 0.3% Au/Ce0.75 -La0.25 nanorods indicated that the catalyst not only kept 100% conversion after continuous operation for 10 h under 70 °C but also showed no deactivation after 10 h on stream at 40 °C. As expected, the activity of 0.3% Au/Ce0.75 -La0.25 nanorods also retained a 100% CO conversion during 50 h at 200 °C. The results revealed that LaO x as the dopant could grow together with CeO2 in one rod. The 1D binary mixed Ce-La nanorods could be a good support for precious metal group catalysts with low content of gold.
Наноматериалы
- Достижения и проблемы флуоресцентных наноматериалов для синтеза и биомедицинских приложений
- Биогенный синтез, характеристика и оценка антибактериального потенциала наночастиц оксида меди против Escheric…
- Синтез композита из электропроводных кремнеземных нановолокон / наночастиц золота с помощью лазерных импуль…
- Биобезопасность и антибактериальная способность графена и оксида графена in vitro и in vivo
- Синтез нанокристаллов ZnO и применение в инвертированных полимерных солнечных элементах
- Синтез композита поли (3,4-этилендиокситиофен) / золото / графен в твердом состоянии и его применение для амперо…
- Легкий синтез червоточиноподобного мезопористого оксида олова за счет самосборки, вызванной испарением, и у…
- Синтез нанопластин Cu2ZnSnSe4 в одном резервуаре и их фотокаталитическая активность, управляемая видимым светом
- Сапонины Platycodon из Platycodi Radix (Platycodon grandiflorum) для зеленого синтеза наночастиц золота и серебра
- Зеленый синтез металлов и наночастиц оксидов металлов и их влияние на одноклеточную водоросль Chlamydomonas reinhardtii



