Биобезопасность и антибактериальная способность графена и оксида графена in vitro и in vivo
Аннотация
В последние годы наночастицы графена (G) и оксида графена (GO) начали применяться для модификации поверхности хирургических имплантатов. Однако биобезопасность и антибактериальная способность G и GO до сих пор не ясны. В этом исследовании биобезопасность G и GO in vitro оценивалась путем совместного культивирования с мезенхимальными стволовыми клетками костного мозга (BMSC), а биобезопасность in vivo наблюдалась путем имплантации материалов в мышечную ткань мышей. Результаты биобезопасности показали, что критическая концентрация для безопасности G и GO составляет 10 мкг / мл. Когда концентрация была более 10 мкг / мл, цитотоксичность G и GO проявляла дозозависимый характер.
Антибактериальные результаты показали, что G проявляет антибактериальную способность при концентрации, равной и более 100 мкг / мл; GO проявлял антибактериальную способность при концентрации 50 мкг / мл и более. Антибактериальный эффект G и GO был дозозависимым in vitro.
Концентрация GO или G от 50 до 100 мкг / мл может быть лучшим диапазоном для сохранения баланса цитотоксичности и антибактериальной способности. Наше исследование показывает, что G и GO могут использоваться в клинике с хорошей биобезопасностью и антибактериальными свойствами в определенном диапазоне концентраций.
Фон
В последние годы хирургические имплантаты широко используются для лечения переломов костей и других заболеваний, но имплантат требует как хорошей биобезопасности, так и антибактериальных свойств, чтобы избежать отторжения и инфицирования. На самом деле ортопедическое лечение инфекционного дефекта кости по-прежнему остается большой проблемой. Что касается бактерий, Staphylococcus aureus является наиболее частым возбудителем в ортопедии и ортопедической имплантологии [1]. Из-за дефекта кости и инфекции [2] лечение затруднено, и пациентам требуется много времени для выздоровления. Если рана не заживает, последнее лечение - ампутация конечности [3, 4].
Хорошее лечение инфекционного дефекта кости должно одновременно удовлетворять требования как по борьбе с инфекцией, так и по восстановлению костного дефекта. С развитием инженерии костной ткани все большее число применений биоматериалов используется в области ортопедического лечения. Таким образом, можно значительно повысить эффективность лечения костной инфекции. Эти материалы в основном включают гетерогенную кость [5], биокерамику [6] (например, гидроксиапатит [7] и фосфат кальция [8]), полимеры [9, 10], белковые материалы (такие как волокна коллагена [11]), и так далее. Наряду с этими материалами Беатрис Пелаз и др. выявили важность и перспективность нанотехнологий в имплантатах [12]; Среди этих наночастиц графен и его производные являются другими новыми материалами, отвечающими требованиям восстановления костей.
Графен двумерный, с одним или несколькими слоями атомов углерода в сотовой структуре [13,14,15]. Он широко используется в композитных материалах [16, 17], сенсорах [18, 19], в энергетике [16, 20] и других областях благодаря своим превосходным физическим свойствам. Оксид графена представляет собой поверхностно-функционализированный графеновый материал, который находится в слое атомов углерода, связанных с двумерным бесконечным протяжением основных поверхностно-активных групп, содержащих кислород и его форму оксида графена [21]. Графен (G) и его производные вызвали серьезную озабоченность в области биомедицины из-за его уникальной двумерной структуры, а также особых физических и химических свойств [22]. Функционализированный графен и его производные выполняют множество функций, таких как загрузка лекарств [23], антибактериальная [24], биоимиджинг [25, 26] и терапия рака [27].
Что касается противомикробной способности, Li et al. показали, что антимикробный механизм G в основном обусловлен переносом заряда [28] и миграцией бактерий. Бактерии переносятся на поверхность острых нанолистов, которые режут бактерии острыми краями [29]. Более того, Tu et al. также продемонстрировали другой потенциальный антимикробный механизм, с помощью которого G может проникать в клетки, что приводит к экстракции большого количества фосфолипидов из клеточных мембран [30]. Таким образом, G и оксид графена (GO) обладают биоактивностью и антимикробной способностью, что соответствует требованиям для квалификации материалов для восстановления кости.
Однако при крупномасштабном производстве и применении вопросы биобезопасности графена особенно важны. Рабочие могут пострадать от воздействия наночастиц (НЧ) через несколько сред, включая ингаляцию, кожный контакт и желудочно-кишечные пути. Андреа Проди и др. предложил поэтапный подход к оценке воздействия НЧ для дальнейшей защиты [31]. Другими ключевыми моментами исследования, за исключением оценки, являются биобезопасность и биосовместимость. Кан Ван и др. продемонстрировали биосовместимость ГО, который проявляет токсичность для клеток фибробластов человека при дозе менее 20 мкг / мл, но проявляет очевидную цитотоксичность при дозе более 50 мкг / мл со значительным снижением клеточной адгезии [32]. В настоящее время более последовательная точка зрения подтверждает, что G и GO обладают токсическим действием на бактерии, но противоречат токсическому действию на клетки [33,34,35,36]. Функции и токсичность G и GO все еще нуждаются в более подробном изучении. Беатрис Пелаз и др. поднял вопрос:«Как снизить риски и увеличить пользу, жизненно важны для разработки безопасных и эффективных наномедицинских препаратов», что напоминает и побуждает исследовать сочетание потенциальных рисков G и GO и антибактериальной способности in vivo и in vitro [12] .
Мезенхимальные стволовые клетки костного мозга (МСКК) являются мультипотентными взрослыми стволовыми клетками. Они стали важным источником клеток для восстановления костных дефектов в тканевой инженерии [37, 38]. Более того, взаимодействие графена с производными и стволовыми клетками до сих пор не изучено [39, 40].
Таким образом, в этом исследовании изучалось влияние G и GO на мышечные ткани мышей in vitro, Staphylococcus aureus . с целью изучить цитотоксичность и антибактериальную способность G и GO in vivo и in vitro, а также способствовать исследованиям наномедицины и нанотоксичности углеродных наноматериалов.
Результаты
Цитотоксичность G и GO
Цитотоксичность G и GO in vitro
Под электронным микроскопом наночастицы G или GO имели неправильную форму размером 30,41 ± 5,59 нм, при этом наблюдалась агломерация частиц (рис. 1а, б). После 7 дней культивирования морфология клетки приняла форму веретена (рис. 1c). Узелки кальция образовывались после культивирования в среде для остеогенной дифференцировки (рис. 1d). Накопление нефти образовалось после адипогенной дифференциации (рис. 1д).
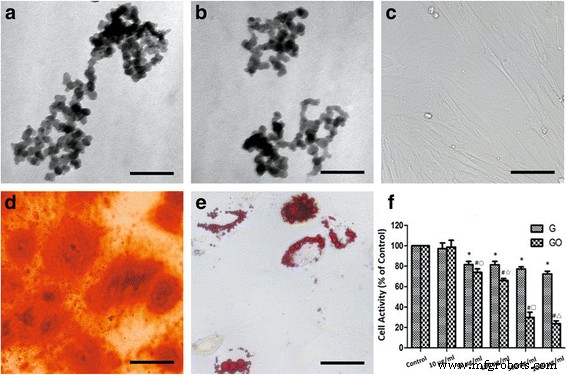
Цитотоксичность G и GO ( a , б). ПЭМ-изображения G ( a ) и GO ( b ) показал сформировавшуюся наносеть. c Цитоморфология BMSC. г Ализарин красный для отложения кальция. е Масло красное О для липидов. е Активность клеток после обработки G и GO, * P <0,01 с контрольной группой, # P <0,01 с контрольной группой, ○ P <0,05 с группой G 50 мкг / мл, ☆, □, △ P <0,01 при той же концентрации группы G. г 2 (G) =0,843, r 2 (GO) =0,939. Масштабные линейки a , b 200 нм, c , d 100 мкм, e 50 мкм. г , коэффициент корреляции
Когда концентрация была выше 10 мкг / мл, G или GO ингибировали рост BMSC. Цитотоксичность была максимальной в группе 1000 мкг / мл и показала дозозависимый характер. Когда концентрация была выше 10 мкг / мл, цитотоксичность группы GO была выше, чем группы G при той же концентрации. Разница была более значительной при увеличении концентрации (рис. 1f).
Под наблюдением SEM, когда концентрация G или GO составляла 10 мкг / мл, BMSC находились в хорошем состоянии с хорошей адгезией и формой. Когда концентрация G составляла более 50 мкг / мл, клетки менялись, включая уменьшение размера, увеличение поверхностной секреции и увеличение микроворсинок на поверхности клетки. Когда концентрация ГО была более 50 мкг / мл, BMSC были обнаружены сморщенными и деформированными, и большинство клеток было мертвым. Эти результаты показали, что GO имеет более высокую цитотоксичность для BMSC по сравнению с G при той же концентрации (рис. 2).
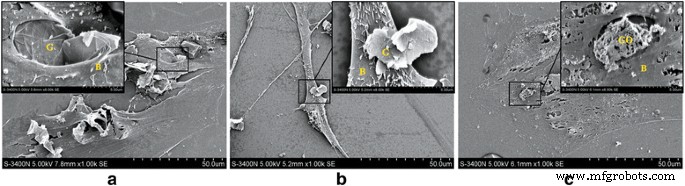
СЭМ-изображения совместной культуры G, GO и BMSC. а Группа G, 10 мкг / мл. Камеры в хорошем состоянии. б Группа G, 50 мкг / мл. Размер клеток уменьшается, поверхностная секреция увеличивается, а микроворсинки на поверхности клетки становятся длинными. c Группа ГО, 50 мкг / мл. BMSC сжимаются и деформируются. G графен, оксид графена GO, BMSC
Под наблюдением ТЕА мы обнаружили, что G или GO могут проникать в BMSC и откладываться на внутренней части ячейки. А когда концентрация была более 50 мкг / мл, были обнаружены изменения клеточного микроокружения, включая нарушение клеточной структуры и микроворсинки, что указывает на более высокую цитотоксичность ГО по сравнению с группой G (рис. 3).
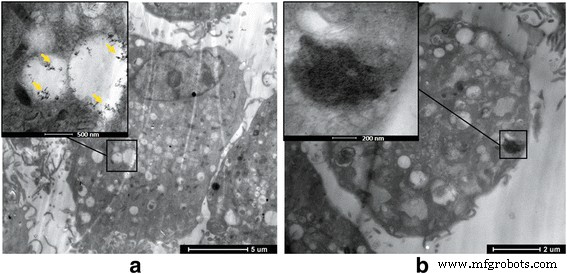
ПЭМ-изображения совместного культивирования G, GO и BMSC. а Группа G. б GO группа. И G, и GO могут приводить к беспорядку клеточной структуры и микроворсинкам на поверхности клетки; GO вызывает изменения клеточного микроокружения с высокой цитотоксичностью
Основываясь на результатах наблюдений SEM и TEM, мы обнаружили, что 10 мкг / мл были критической концентрацией для безопасности для G и GO. Когда концентрация ГО была более 10 мкг / мл, ГО имел более высокую цитотоксичность для BMSC по сравнению с G.
Цитотоксичность G и GO in vivo
Чтобы проанализировать цитотоксичность G и GO in vivo, мы выбираем скелетную ткань для представления и моделирования местных условий трансплантации в ортопедии. Результат окрашивания HE скелетной ткани в контрольной группе и группе G представлял нормальную структуру с мышечными миофибриллами, параллельными вертикальной оси. На поперечном срезе миофибриллярный разрез представлен тонкими пятнами, а ядро расположено на краю клеток. Вышеупомянутые изменения также могут быть обнаружены в нормальных скелетных клетках, что указывает на низкую токсичность G по отношению к мышечным тканям.
Напротив, в группе ГО поперечные линии мышечных волокон в продольном сечении были сломаны и нечеткие, что свидетельствует об атрофии и некрозе мышц. Таким образом, ГО имел более высокую токсичность для животных (рис. 4).
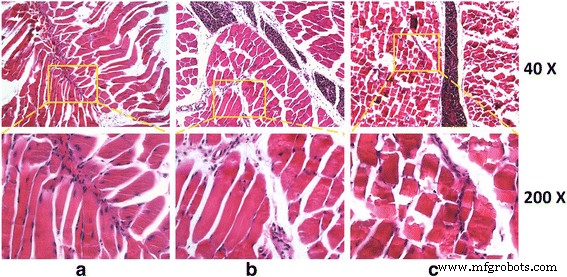
Срезы тканей окрашены HE-окрашиванием. а Контроль представляет собой неповрежденную ткань. б Группа G. Скелетные клетки представлены в виде прямой полосы. Миофибриллы мышц параллельны по длинной оси, поперечные линии четкие, поперечное сечение - неправильные блоки. Миофибриллярный разрез представлен тонкими пятнами; ядро находится на краю. c GO группа. Поперечные линии мышечных волокон в продольном сечении изломаны и нечеткие
Антибактериальные свойства G и GO
Антибактериальная способность in vitro
В эксперименте по бактериостазу in vitro фотонная интенсивность ROI G или GO была зависимой от дозы. И интенсивность фотонов уменьшалась вместе с увеличением концентрации. По сравнению с группой G при той же концентрации, группа GO имела более низкую интенсивность фотонов (рис. 5).
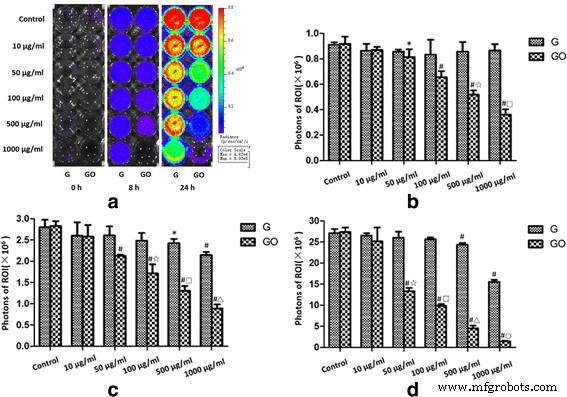
Мониторинг интенсивности биолюминесценции S . aureus in vitro. G и GO демонстрируют дозозависимую антибактериальную способность in vitro. а Биолюминесценция Xen-29, полученная in vitro через 0, 8 и 24 ч инкубации при 37 ° C, с вариациями цвета, отражающими интенсивность света (Bin M (8), FOV12, f1, 15 s). б PI =0 ч, r 2 (ГО-0 ч) =0,924. c PI =8 ч, r 2 (G-8 h) =0,584, r 2 (ГО-8 ч) =0,960. г PI =24 ч, r 2 (G-24 ч) =0,616, r 2 (GO-24 ч) =0,943. * P <0,01 с контрольной группой, # P <0,01 с контрольной группой, ☆, □, △, ○ P <0,01 при той же концентрации группы G. г , коэффициент корреляции
В 0, 8 и 24 часа, когда концентрации G составляли 100, 500 и 1000 мкг / мл, G проявлял способность ингибировать рост Xen-29 по сравнению с контрольной группой. Однако интенсивность фотонов в группах 10 и 50 мкг / мл не показала значительных различий по сравнению с контрольной группой.
Когда концентрации GO составляли 50, 100, 500 и 1000 мкг / мл, через 0, 8 и 24 ч, GO проявлял эффект ингибирования роста по отношению к Xen-29. Аналогичным образом, интенсивность фотонов в группах 10 и 50 мкг / мл не показала статистически значимой разницы по сравнению с контрольной группой.
Результаты показали, что G проявлял антибактериальную способность при концентрации более 100 мкг / мл, а GO проявлял антибактериальную способность при концентрации более 50 мкг / мл. Антибактериальная способность G или GO зависела от дозы. GO обладал более сильной антибактериальной способностью по сравнению с G в той же концентрации.
Антибактериальная способность in vivo
В эксперименте по бактериостазу in vivo группа GO показала значительно более низкое значение интенсивности фотонов (PI) через 0 и 24 часа. Значение PI было снижено по сравнению с группой G и контрольной группой. Однако значение PI группы G не отличалось статистически значимо по сравнению с контрольной группой (рис. 6). Результаты показали, что GO продемонстрировал сильную антибактериальную способность, но G не показал очевидной антибактериальной способности in vivo при концентрации 100 мкг / мл.
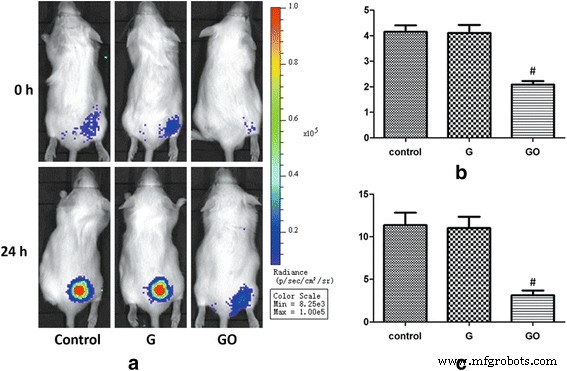
Мониторинг интенсивности биолюминесценции S . aureus in vivo. GO демонстрирует дозозависимую антибактериальную способность in vivo. а Биолюминесценция Xen-29, отображаемая in vivo через 0 и 24 ч инкубации, с вариациями цвета, отражающими интенсивность света (ячейка M (8), FOV12, f1, 60 с). б PI =0 ч, # P <0,01 с контрольной группой. c PI =24 ч, # P <0,01 с контрольной группой
Обсуждение
С развитием тканевой инженерии все большее число применений биоматериалов используется в области ортопедического лечения [41]. Для биоматериалов необходима хорошая биобезопасность. G и GO широко используются в области медицины из-за их безопасности и уникальных физических и химических свойств. С точки зрения антибактериальной способности G и GO являются хорошими антибактериальными веществами. Основными антибактериальными механизмами являются перенос заряда [28, 29] и проникновение в клетки [30]. Таким образом, антибактериальные свойства G и GO могут соответствовать требованиям, предъявляемым к материалам для восстановления костей, в пределах безопасных диапазонов.
В этом исследовании, чтобы определить свойства биобезопасности, мы наблюдали цитотоксический эффект G и GO в отношении BMSC через SEM и TEM, и этот эффект был представлен как дозозависимый характер. Кроме того, ГО обладал более высоким цитотоксическим действием. Что касается антибактериальных свойств, мы также наблюдали, что G и GO обладают антибактериальными свойствами в зависимости от дозы, и эффект GO был значительно лучше, чем G in vivo. В заключение следует отметить, что концентрация в диапазоне 50–100 мкг / мл может быть лучше для сохранения баланса между незначительным цитотоксическим эффектом и основной антибактериальной способностью.
Это исследование продемонстрировало, что и G, и GO обладают цитотоксическим действием в отношении BMSC и скелетных клеток, а токсичность GO выше, чем G. Большое количество исследований продемонстрировало токсичность G наноклеток и его физические и химические свойства материала (например, размер, форма и поверхностные функциональные группы) по отношению к клеткам [35, 42, 43]. Кроме того, исследователи обнаружили, что чистый G может вызывать цитотоксичность за счет истощения потенциала митохондриальной мембраны (MMP) и увеличения количества внутриклеточных активных форм кислорода (ROS) [12], таким образом, запуская апоптоз путем активации митохондриального пути [34, 44]. . Но тот феномен, что цитотоксичность ГО выше, чем G, может быть связан с группами, содержащимися на поверхности ГО [45]. Исследователи обнаружили, что цитотоксичность ГО напрямую связана с содержанием сыворотки. Hu W et al. продемонстрировали, что ГО обладает сильной адсорбционной способностью, которая может адсорбировать сывороточный белок с образованием белковых включений [46], демонстрируя более высокую цитотоксичность ГО по сравнению с G. Наши эксперименты подтвердили выводы, упомянутые выше. Кроме того, токсичность для животных является еще одним важным показателем оценки биологической безопасности G и GO. В этом исследовании серьезный патологический ответ в мышечных тканях был обнаружен в группе GO, что указывает на его более высокую токсичность по сравнению с группой G.
Во-вторых, антибактериальные свойства соответствуют изменениям доз G и GO; Концентрация 50 ~ 100 мкг / мл GO может лучше сбалансировать биологическую токсичность и антибактериальную способность. Наши исследования показали, что и биологическая токсичность, и антибактериальная способность проявляются в зависимости от дозы. Следовательно, некоторый диапазон концентраций может поддерживать баланс между незначительной биологической токсичностью и основной антибактериальной способностью.
Результаты показали, что и G, и GO обладают некоторой биологической токсичностью по отношению к BMSC и мышечным тканям, но в группе GO антибактериальная способность была значительной in vivo. Основываясь на предыдущих результатах токсичности G и GO, мы обнаружили, что концентрация 50 ~ 100 мкг / мл может быть лучшей для сохранения баланса между незначительной биологической токсичностью и основной антибактериальной способностью, обеспечивая тем самым новые доказательства в отношении биобезопасности и антибактериальности. способность G и GO in vivo и in vitro в клинической работе.
Хотя ГО обладает сильным токсическим действием, его можно избежать с помощью модификаций ГО [47, 48]. В то же время модифицированные материалы GO могут разлагаться и очищаться в организме [49]; Таким образом, требуется новое направление исследований модификации ГО. Более того, влияние G и GO на другие важные органы или ткани все еще требует дальнейших исследований, чтобы достичь медицины холизма. Между тем, требует дальнейшего изучения вопрос о том, вызывает ли ГО окислительный стресс у бактерий и наличие дополнительных антибактериальных механизмов. Перед применением в тканевой инженерии механизмы токсичности G и GO и модифицированные способы снижения токсичности все еще нуждаются в уточнении.
Методы
Животные
Самцы крыс Sprague-Dawley (SD) и самцы мышей Balb / C были приобретены в Институте Пастера в Иране и содержались в условиях 12-часовой свет / темнота при 25 ° C. Крыс SD в возрасте 4 недель использовали для выделения BMSC. Мышей Balb / C использовали для экспериментов на животных in vivo. Все животные были выращены в Центре лабораторных животных Четвертого военного медицинского университета, и операции проводились в соответствии со Стандартом экспериментальной хирургии на животных госпиталя Сицзин. Все эксперименты на животных были одобрены Комитетом по уходу и использованию животных Четвертого военного медицинского университета.
Графен и оксид графена
G или GO (слои 1-2) (Hengqiu Graphene Technology, Китай) добавляли соответственно в абсолютный этанол (используемый для теста просвечивающего электронного микроскопа, ТЕМ), буфер PBS (используемый для экспериментов на клетках in vitro) и физиологический раствор (используемый для эксперименты на животных in vivo) для приготовления раствора G или GO (результаты тестирования спектроскопии комбинационного рассеяния были предоставлены компанией Hengqiu Graphene Technology). Начальная концентрация раствора G или GO составляла 1 мг / мл. Раствор G или GO диспергировали с помощью ультразвука за 2 ч до экспериментов.
Цитотоксичность
Культура клеток
Среда для культивирования клеток содержала 10% фетальной бычьей сыворотки (Гибко, Карлсбад, Калифорния, США), DMEM / F12 (Корнинг, Нью-Йорк, США), 100 Ед / мл пенициллина и 100 Ед / мл стрептомицина (Sigma, Сент-Луис, США). Миссури, США). BMSC были выделены у 4-недельных самцов крыс методом культивирования костного мозга [50]. После казни крысы бедренную и большеберцовую кости удаляли в асептических условиях. Медуллярная полость промывалась средой для культивирования клеток; затем смесь центрифугировали при 1500 об / мин в течение 10 мин для сбора костного мозга. Костный мозг ресуспендировали в среде для культивирования клеток и инокулировали во флаконы для культивирования клеток, покрытые желатином, при 37 ° C и инкубаторе для клеток с 5% диоксидом углерода. Среду во флаконах для культивирования клеток меняли через 48 часов и удаляли неприлипшие клетки; затем культуральную среду меняли каждые 48 ч. Для следующих экспериментов использовали клетки с третьего по пятый пассаж.
Остеогенную дифференцировку и адипогенную дифференцировку на BMSC проводили с помощью среды для дифференцировки (Cyagen, CA, США). После 2-недельной индукции дифференцировки клетки фиксировали 4% -ным раствором формальдегида в течение 30 мин; затем были выполнены окрашивание ализариновым красным для остеогенной дифференциации и масляное красное окрашивание для адипогенной дифференцировки.
Активность ячейки
Концентрация суспензии BMSC была доведена до 5 × 10 4 / л, и клетки культивировали в 96-луночном планшете по 100 мкл в каждой лунке. Через 24 ч среду заменяли средой для культивирования клеток, содержащей G или GO с концентрациями 0 (как контрольная группа), 10, 50, 100, 500 и 1000 мкг / мл. После 24-часового культивирования в каждую лунку добавляли 10 мкл alamarBlue (Bio-rad, Hercules, CA, USA) для дальнейшего 4-часового культивирования. Микропланшет (Bio-rad, Геркулес, Калифорния, США) использовался для определения значений OD (оптической плотности) при 570 и 600 нм, а затем колориметрический калькулятор alamarBlue® (Bio-rad, Геркулес, Калифорния, США) был использован для оценить скорость разрастания клеток.
Характеристика с использованием SEM
BMSC засевали в тонкую стеклянную пластину с 24 отверстиями толщиной 0,17 мм и диаметром 14 мм. Через 24 ч культивирования среду заменяли средой для культивирования клеток, содержащей G или GO с концентрациями 0 (как контрольная группа), 10, 50, 100, 500 и 1000 мкг / мл. Клетки продолжали культивировать в течение 24 часов, после чего супернатант удаляли. Клетки фиксировали 2,5% раствором глутаральдегида в течение 24 ч. Затем клетки наблюдали с помощью сканирующего электронного микроскопа (Hitachi S-4800 SEM, JPN) после обезвоживания и золочения.
Характеризация с использованием ТЕА
Суспензию G и GO доводили до 50 мкг / мл. Клетки культивировали совместно с G или GO в течение 24 ч, а затем переваривали 0,25% трипсином. Супернатант удаляли после центрифугирования при 1000 об / мин в течение 10 мин. Клетки фиксировали 2,5% раствором глутаральдегида в течение 24 часов, и срезы наблюдали с помощью просвечивающей электронной микроскопии (FEI Tecnai G2 TEM, США).
Токсичность и идентификация мышечной ткани
Чтобы проанализировать цитотоксичность G и GO in vivo, мы выбираем скелетную ткань для представления и моделирования местных условий трансплантации в ортопедии. G или GO вводили соответственно в ткани медиальной бедренной мышцы мышей Balb / C. Мышей умерщвляли через 7 дней, и мышечные ткани, инъецированные G или GO, фиксировали 10% нейтральным раствором формальдегида в течение 24 часов. После обезвоживания спиртом ткань обертывали парафином и нарезали срезы для окрашивания гематоксилином и эозином (HE). Срезы наблюдали под инвертированным микроскопом (инвертированный микроскоп Leica DMI6000B, RBT).
Антибактериальная способность
Бактериальная культура
Мы выбрали Xen-29 для культивирования из-за его люминесцентной реакции. Xen-29 был биолюминесцентной бактерией Staphylococcus aureus . (Caliper, LS, USA), полученный из ATCC-12600. Бактерии культивировали в среде Лурия Бертани (LB, Sigma, Сент-Луис, Миссури, США), содержащей 200 мкг / мл канамицина (Sigma, Сент-Луис, Миссури, США), при 37 ° C. Одиночную колонию отбирали в бульон LB при 37 ° C при встряхивании в течение 2–3 ч со скоростью 200 об / мин. Когда поглощение при 600 нм достигло 0,5 (примерно эквивалентно 1,44 × 108 КОЕ / мл) по сравнению с поглощением в холостом растворе LB, бактерии были использованы для следующего эксперимента.
Биолюминесцентное изображение
Для получения биолюминесцентных изображений мы использовали охлаждаемую CCD оптическую макроскопическую систему визуализации IVIS Lumina II (Caliper, LS, США). Бактериальный биолюминесцентный сигнал был преобразован в интенсивность фотонов (PI). Программное обеспечение Living Image® 4.2 (Caliper, LS, USA) использовалось для количественной оценки PI в интересующих регионах (ROI). Чтобы предотвратить движение мышей в процессе визуализации, мышей анестезировали, чтобы избежать нестабильности принимаемого сигнала.
Антибактериальная способность in vitro
Xen-29 добавляли в 24-луночный планшет, и концентрация в каждой лунке составляла 10 7 . КОЕ. Затем добавляли суспензию G или GO для доведения концентрации до 0 (контроль), 10, 50, 100, 500 и 1000 мкг / мл. Постоянный объем в каждой лунке составлял 500 мкл. Чтобы проанализировать антибактериальную способность G и GO, бактериальный ИП в ROI был последовательно измерен через 0, 8 и 24 часа после вмешательства.
Антибактериальная способность in vivo
На основании результатов экспериментов, приведенных выше, была выбрана группа 100 мкг / мл для определения антибактериальной способности. Суспензию Xen-29 (200 мкл) вводили в ткани медиальной бедренной мышцы мышей Balb / C. ИП ROI был обнаружен через 0 и 24 ч после операции.
Анализ данных
Все данные были представлены как среднее значение ± стандартное отклонение (SD). Студенческий t Тест использовался для сравнения G и GO с одинаковой концентрацией. Односторонний дисперсионный анализ (ANOVA) использовался для сравнения различий между G и GO с разной концентрацией соответственно. P <0,05 считалось статистически значимым.
Выводы
В заключение, G и GO обладают некоторым биологическим цитотоксическим действием в зависимости от дозы. G и GO обладают антибактериальными свойствами и также действуют в зависимости от дозы; Антибактериальные свойства GO значительно лучше, чем G in vivo. Концентрация 50 ~ 100 мкг / мл может быть лучше для поддержания баланса незначительной биологической токсичности и основной антибактериальной способности. Более того, модификации GO для снижения токсичности должны быть уточнены, чтобы способствовать применению G и GO в наномедицине.
Сокращения
- BMSC:
-
Мезенхимальные стволовые клетки костного мозга
- G:
-
Графен
- GO:
-
Оксид графена
- HE:
-
Гематоксилин и эозин
- LB:
-
Лурия Бертани средний
- НП:
-
Наночастицы
- PI:
-
Интенсивность фотона
- ROS:
-
Активные формы кислорода
- SEM:
-
Сканирующий электронный микроскоп
- ТЕМ:
-
Просвечивающая электронная микроскопия
Наноматериалы
- Графен в динамиках и наушниках
- Биогенный синтез, характеристика и оценка антибактериального потенциала наночастиц оксида меди против Escheric…
- Графен и полимерные композиты для суперконденсаторов:обзор
- Нанокомпозиты из оксида графена, украшенные титанатом:получение, огнестойкость и фотодеградация
- Биобезопасность и антибактериальная способность графена и оксида графена in vitro и in vivo
- Оценка структур графен / WO3 и графен / CeO x как электродов для применения в суперконденсаторах
- Получение наноразмерного CL-20 / оксида графена в один этап с помощью шаровой мельницы для значительного уменьш…
- Сравнительное исследование биосинтезированных наночастиц оксида меди и цинка in vivo путем внутрибрюшинного и…
- Повышенная протонная проводимость и снижение проницаемости для метанола с помощью биомембраны из альгината…
- Свойства наночастиц оксида цинка и их активность против микробов



