Электрохимическое восстановление CO2 на полых кубических нанокомпозитах Cu2O @ Au
Аннотация
Без ПАВ и с низким содержанием золота Cu 2 O @ Au и Au полые кубики на основе электроосажденной Cu 2 Кубики O в качестве принесенных в жертву шаблонов были приготовлены с помощью реакции гальванического замещения (GRR). Электрокаталитические характеристики свежеприготовленных катализаторов по отношению к диоксиду углерода (CO 2 ) электрохимическое восстановление. Результаты экспериментов показывают, что Cu 2 Катализатор O @ Au может преобразовывать CO 2 до окиси углерода (CO) с максимальной фарадеевской эффективностью (FE) ~ 30,1% при потенциале -1,0 В (по сравнению с RHE) и примерно вдвое превышает FE других катализаторов при том же потенциале. Для сравнения, такое электрокаталитическое усиление объясняется границей раздела металл-оксид в Cu 2 O @ Au.
Фон
CO 2 считается основным парниковым газом, который способствует глобальному потеплению; следовательно, поиск эффективного способа преобразования / хранения CO 2 привлекает к себе все большее внимание [1, 2]. Основные методы снижения CO 2 концентрация в атмосфере включает CO 2 улавливание и хранение под землей [3, 4] или преобразование в химикаты с добавленной стоимостью [5,6,7]. Благодаря стабильным химическим свойствам CO 2 , необходимо использовать высокую температуру, высокое давление или катализатор, чтобы сделать его реактивным. Учитывая затраты на энергию и экономию, электрохимическое преобразование CO 2 в мягких условиях - многообещающая стратегия для уменьшения избыточных парниковых газов и достижения искусственного углеродного цикла [8,9,10]. Однако основные трудности в CO 2 электрохимическое восстановление - это внутренняя стабильность CO 2 , нижний потенциал CO 2 реакция восстановления (CO 2 RR) и низкой селективностью по продуктам восстановления [11]. Таким образом, необходимо срочно развивать CO 2 . катализаторы восстановления с высокой селективностью, хорошей стабильностью и отличной активностью.
Предыдущие исследования показывают, что несколько металлических электродов, таких как Au, Ag, Cu, Pd и Sn, являются привлекательными кандидатами для CO 2 RR [12]. Среди них медь является единственным металлическим катализатором, который, как обнаружено, дает значительное количество углеводородных продуктов C1 – C3 и спиртов [13]. Au, который является высокоактивным катализатором по отношению к CO 2 электрохимическое восстановление, может производить CO из CO 2 с высокой селективностью и низким перенапряжением [11]. За исключением Cu и Au, другие металлические электроды, включая Ag, Pd и Sn, в основном преобразуют CO 2 в CO или форматировать (HCOO - ) через двухэлектронный путь переноса [14,15,16,17]. Однако, с одной стороны, сложно улучшить селективность и стабильность катализаторов на основе Cu в отношении электрохимического восстановления CO 2 . к углеводородным продуктам С1 – С3. С другой стороны, Au очень селективен для производства CO, но его высокая стоимость и обилие редкоземельных элементов препятствуют его индустриализации в CO 2 RR [18, 19]. Композиты на основе меди и золота имеют большой потенциал для CO 2 электрохимическое восстановление. Но большинство известных в настоящее время катализаторов CuAu было синтезировано сольвотермическим методом [20]. Морфологию наночастиц трудно контролировать, и эти частицы имеют тенденцию легко окисляться и агрегироваться [21, 22]. Поэтому очень важно разработать композит золота и меди с контролируемой морфологией, высокой стабильностью и высокой селективностью продукта по CO 2 электрохимическое восстановление. Кроме того, сообщается, что поверхность раздела металл-оксид может улучшить электрокаталитическую активность катализаторов по отношению к CO 2 RR [23].
В этой статье мы сообщаем о Cu 2 без ПАВ. O @ Au нанокомпозит, в котором Cu 2 Интерфейс O / Au был создан для электрокаталитического восстановления CO 2 в воде. Для сравнения, полые кубические Au-катализаторы были приготовлены растворением Cu 2 O в Cu 2 O @ Au катализаторы в аммиаке. Результаты экспериментов показали, что граница раздела металл / оксид в Cu 2 Катализатор O @ Au может активировать инертный CO 2 молекулы и увеличивают FE CO. FE CO составляет 30,1% по Cu 2 O @ Au электрод при -1,0 В (по сравнению с RHE), что вдвое больше, чем на Cu 2 Электроды O и Au, подготовленные в данной работе. Этот результат не только доказал, что поверхность раздела металл-оксид может улучшить электрокаталитическую активность электродов по отношению к CO 2 . RR, но также открыли путь для синтеза катализаторов на основе оксидов металлов.
Методы
Материалы
Трифторацетат меди (II) (Cu (TFA) 2 , 98%), трифторацетат калия (KTFA, 98%) и золотохлористоводородная кислота (HAuCl 4 , 99,9%) были приобретены у Sigma-Aldrich и использовались напрямую без какой-либо очистки. Все растворы были приготовлены на сверхчистой воде Milli-Q (Millipore ≥ 18,2 МОм см). Азот (N 2 ) (99,999%) и CO 2 Газы (99,999%), использованные в эксперименте, были приобретены у Foshan MS Messer Gas CO., Ltd. Копировальная бумага толщиной 0,3 мм была приобретена у Hesen в Шанхае.
Приготовление Cu 2 O нанокубы и Cu 2 O @ Au
Cu 2 Нанокубы O были синтезированы в соответствии с методом, описанным в предыдущей литературе [24]. Кубический Cu 2 Наночастицы O были электроосаждены на копировальную бумагу (1 см × 1 см) с использованием хроноамперометрии при -0,06 В (по сравнению с SCE) в течение 1 ч в 10 мМ Cu (TFA) 2 и 0,2 М раствор KTFA. Перед Cu 2 При электроосаждении нанокубов копировальную бумагу несколько раз промывали водой и этанолом.
Приготовление Cu 2 Композит O @ Au погружал Cu 2 Кубики O в 2 мл HAuCl 4 (1 мМ) раствор в течение 30 мин при 277 К.
Приготовление полого кубического Au
Свежеприготовленный Cu 2 Композит O @ Au был погружен в 2 M водный аммиак на 12 часов при 277 K для удаления Cu 2 . O и сохранить на копировальной бумаге полый кубический Au.
Характеристика
Морфология и структура наноматериалов были охарактеризованы с помощью сканирующей электронной микроскопии (SEM, JEOL-6701F), оснащенной детекторной системой энергодисперсионного рентгеновского излучения (EDX). Картины дифракции рентгеновских лучей (XRD) были записаны с использованием рентгеновского дифрактометра Rigaku Ultima IV с Cu Kα-излучением (λ =1,5406 Å) для изучения составов продуктов.
Электрохимические измерения CO 2
Электрохимические измерения проводили на приборе CH Instruments 760D (Chenhua, Shanghai) и трехэлектродной системе. СО 2 Электрохимическое восстановление проводили в двухкамерной ячейке H-типа с Ag / AgCl и платиновым листом (1 см × 1 см), используемыми в качестве электрода сравнения и противоэлектрода, соответственно. Компенсация падения iR на 85% использовалась в CO 2 электрохимическое восстановление. В этой работе все потенциалы указаны в CO 2 электрохимическое восстановление сравнивали с обратимым водородным электродом (RHE). RHE использовал следующее преобразование: E RHE (V) = E Ag / AgCl (В) + 0,197 В + (0,059 В × pH) [25]. Схематический эскиз электрохимической ячейки H-типа показан на рис. 1. Две электрохимические ячейки были разделены протонообменной мембраной (Nafion 117, Sigma-Aldrich).
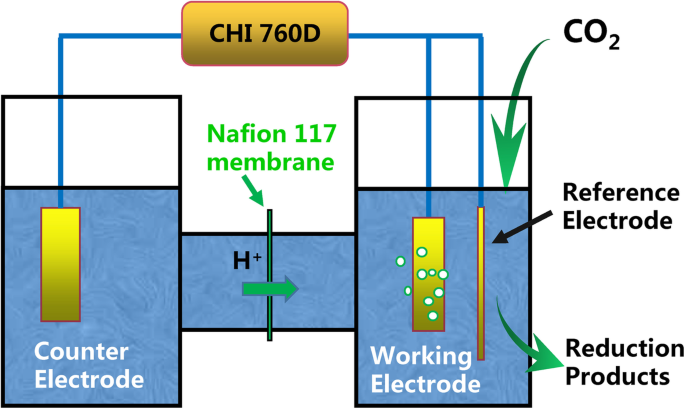
Схематическое изображение электрохимической ячейки H-типа
Эксперименты по линейной вольтамперометрии (LSV) проводили в 0,1 M KHCO 3 решение под N 2 (99,999%) или CO 2 (99,999%) атмосфера. Перед тестами LSV N 2 или CO 2 продували раствор в электрохимической ячейке H-типа в течение 20 мин соответственно.
Перед CO 2 В экспериментах RR раствор электролита насыщался в течение 20 мин CO 2 и pH 0,1 М KHCO 3 раствор был около 8,6. СО 2 электрохимическое восстановление проводили в потенциостатических условиях, отслеживая ток и концентрацию продукта. Свежеприготовленные материалы использовали в качестве рабочих электродов. СО 2 RR-эксперименты повторяли трижды при каждом потенциале. Обнаружение CO 2 продукты восстановления использовали с помощью онлайн-газовой хроматографии (GC Agilent, 7890B). Запуск ГХ проводился каждые 930 с. ГХ был оборудован двумя колонками Plot-Q, детектором теплопроводности (TCD), пламенно-ионизационным детектором (FID) и деметанизатором с N 2 (99,999%) в качестве газа-носителя. В данной работе не учитывалось содержание жидких продуктов. Во время CO 2 RR эксперименты, CO 2 вентилировался в катодную электролизерную ячейку со скоростью потока 20 мл / мин -1 постоянно.
$$ {i} _x =\ frac {C_x \ cdot q \ cdot p} {RT} \ cdot {n} _xF $$ (1) $$ \ mathrm {FE} \ left (\% \ right) =\ frac {i_x} {i_ {total}} \ cdot 100 $$ (2)Уравнение расчета FE показано в уравнениях. 1 и 2, в которых i всего - плотность тока, зарегистрированная потенциостатом во время CO 2 RR [26]. Частичный ток ( i x ), который необходим для создания каждого продукта ( x =H 2 , CO, CH 4 , С 2 H 4 ) выводится из уравнения. 1. C x извлекается из калибровочной кривой ГХ объемная концентрация продукта x . нет x это количество уменьшенных электронов, необходимых для производства x от молекул углекислого газа. q - расход газа, p постоянное давление, а T это комнатная температура. R - газовая постоянная, а F постоянная Фарадея.
Результаты и обсуждение
Морфология
Морфология и структура полученного Cu 2 O и Cu 2 Нанокубки O @ Au, охарактеризованные методом сканирующей электронной микроскопии, показаны на рис. 2. Cu 2 Электроосажденные на копировальную бумагу нанокубцы O имели правильную форму и гладкую поверхность (рис. 2а). Средняя длина кромки Cu 2 Размер кубиков O составлял около 1 мкм, как показано на рис. 2b. Соответствующее время реакции и Au 3+ концентрация раствора GRR на Cu 2 Наночастицы O будут производить Cu 2 Наноструктуры O @ Au, как показано на рис. 2c и d.

СЭМ-изображения Cu 2 O нанокубы ( a , b ), Cu 2 Наночастицы O @ Au ( c , d ) и EDX Cu 2 Наночастицы O @ Au ( e , f )
После Cu 2 Нанокубики O были погружены в HAuCl 4 . (1 мМ) раствор в течение 30 мин, поверхностное распределение Au и Cu Cu 2 Композиты O @ Au были исследованы с помощью EDX-картирования, показанного на рис. 2e и f. Он показал, что наночастицы Au были равномерно распределены на Cu 2 O поверхность нанокуба. GRR между Cu 2 O и HAuCl 4 вовлекает эволюцию внутреннего полого ядра и поверхностное осаждение наночастиц Au [27, 28].
Как показано на рис. 3, Cu 2 O в Cu 2 Композиты O @ Au были удалены, и оставшиеся наночастицы Au унаследовали кубический каркас Cu 2 Композиты O @ Au, после Cu 2 Нанокубки O @ Au погружали в аммиачную воду на 12 ч. Маленькие наночастицы Au в полой кубической структуре Au имели диаметр около 20-30 нм.

СЭМ-изображения полого кубического Au ( a - c ) разного увеличения
XRD-анализ
Кристаллическую структуру приготовленных катализаторов исследовали методом XRD, и дифрактограммы показаны на фиг. 4. Дифракционный пик при 2 θ = 54,51 ° принадлежит копировальной бумаге. Пики дифракции при 2 θ =36,46, 42,36, 61,44 и 73,55 ° относятся к (111), (200), (220) и (311), соответственно, Cu 2 Куб O (JCPDS 78-2076). Четыре слабых пика при 2 θ = 38,18, 44,39, 64,57 и 77,54 ° относятся к (111), (200), (220) и (311) соответственно Au (JCPDS 04-0784), которые заменили Cu 2 О на копировальной бумаге. Большая часть Cu 2 O заменены на Au; таким образом, дифракционные пики соответствовали Cu 2 O исчез на дифрактограмме полого кубического Au.
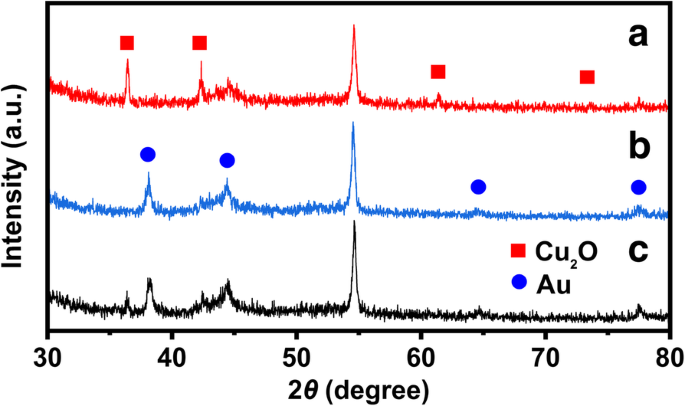
Картины XRD (a) Cu 2 Куб O, (б) полый кубический Au и (в) Cu 2 O @ Au
CO 2 Электрохимическое восстановление
Кривые LSV для Cu 2 Куб O, Cu 2 O @ Au, а полые кубические Au электроды показаны на рис. 5. Условия эксперимента LSV были получены при катодной скорости развертки 50 мВ с −1 с N 2 -насыщенный или CO 2 -насыщенный 0,1 M KHCO 3 решение. Плотность тока всех трех образцов под N 2 атмосфера выше, чем при CO 2 ; это различие может быть вызвано реакцией выделения водорода (HER) на Cu 2 Куб O, Cu 2 O @ Au, и полого кубического Au, т.е. с непрерывным потоком CO 2 в катодной электролитической ячейке поверхность электрода покрыта адсорбированными молекулами CO, которые ингибируют HER на поверхности электрода и уменьшают ток восстановления [29]. Плотность тока Cu 2 O @ Au электрод в CO 2 -насыщенный 0,1 M KHCO 3 раствор выше Cu 2 О и полые кубические Au электроды, как показано на рис. 5d.
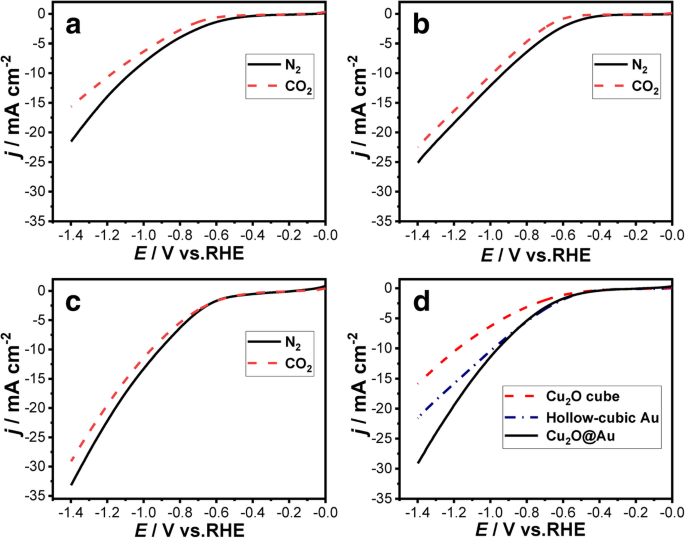
Кривые LSV, полученные на a Cu 2 O куб, b полый кубический Au и c Cu 2 O @ Au электродов в N 2 -насыщенный (черная сплошная линия) и CO 2 -насыщенный (красная пунктирная линия) 0,1 M KHCO 3 решения. г Кривые LSV трех образцов в CO 2 -продувка 0,1 млн KHCO 3 решения
Электрохимический метод амперометрии i - т был использован для оценки производительности CO 2 RR в 0,1 млн KHCO 3 раствор при комнатной температуре и атмосферном давлении. Для последующего определения продукта потенциалы устанавливаются в диапазоне от –0,7 до –1,2 В. При разных потенциалах ФЭ H 2 и CO для CO 2 RR на Cu 2 Кубы O имеют существенное различие, как показано на рис. 6а, т.е. FE H 2 уменьшается, потому что поверхность Cu 2 Кубы O покрыты молекулами CO, произведенными CO 2 RR, а HER ингибируется [30]. ИП ЦО 4 и C 2 H 4 незначительно различаются по разным потенциалам.
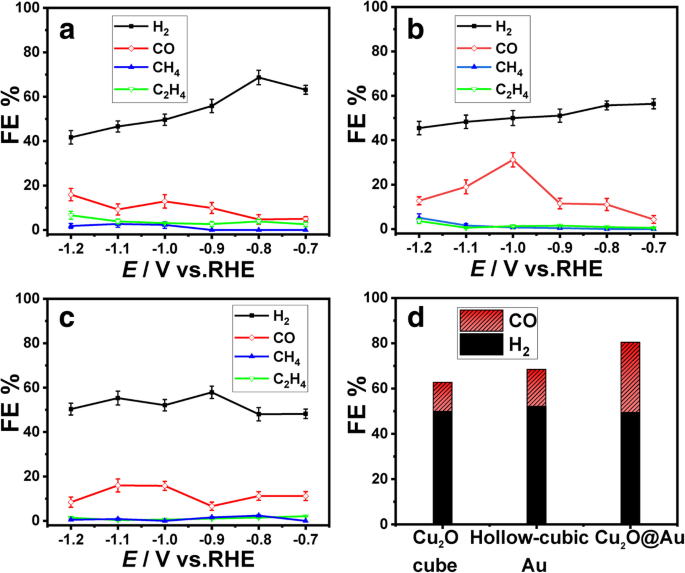
ИП из а Cu 2 Кубический катализатор, b Cu 2 Катализатор O @ Au и c полый кубический Au-катализатор. г Сравнение FE для CO и H 2 при - 1,0 В против RHE на трех катализаторах
КЭ Cu 2 Катализатор O @ Au показан на рис. 6б. КЭ СО сохраняет тенденцию к росту с потенциальным снижением и достигает максимума 30,1% при -1,0 В (по сравнению с RHE). ИП H 2 снижается с 56,7 до 45,6%. По сравнению с Cu 2 O @ Au катализатор, максимальный CO FE полого кубического Au-катализатора составляет 16,3% при -1,0 В (рис. 6c). CO FE Cu 2 Катализатор O @ Au при –1,0 В примерно в два раза больше, чем катализатор из полого кубического Au при том же потенциале. Cu 2 Композит O @ Au демонстрирует превосходную каталитическую активность по отношению к CO 2 электрохимическое восстановление, чем Cu 2 O-кубический катализатор и полый кубический Au-катализатор, и это связано с межфазным эффектом оксидов металлов.
Чтобы понять механизм реакции на CO 2 От RR к CO мы рассмотрели следующие этапы реакции:
$$ {\ mathrm {CO}} _ 2 \ left (\ mathrm {g} \ right) + \ ast + {\ mathrm {H}} ^ {+} \ left (\ mathrm {aq} \ right) + {\ mathrm {e}} ^ {-} {\ to} ^ {\ ast} \ mathrm {COOH} $$ (3) $$ {} ^ {\ ast} \ mathrm {CO} \ mathrm {OH} + {\ mathrm {H}} ^ {+} \ left (\ mathrm {aq} \ right) + {\ mathrm {e}} ^ {-} {\ to} ^ {\ ast} \ mathrm {CO} + {\ mathrm {H}} _ 2 \ mathrm {O} \ left (\ mathrm {l} \ right) $$ (4) $$ {} ^ {\ ast} \ mathrm {CO} \ to \ mathrm {CO} \ left ( \ mathrm {g} \ right) + \ ast $$ (5)Как правило, уравнение. 3 воспринимается как потенциальная ограничивающая ступень для CO 2 RR в CO [23]. Соответствующая энергия связи может быть существенно снижена на границе раздела Cu 2 O @ Au по сравнению с Cu 2 O поверхность куба или поверхность Au. Кроме того, уравнение. 4 и уравнение. 5 также облегчаются на Cu 2 O @ Au интерфейс. Это указывает на то, что межфазный эффект оксидов металлов может увеличивать CO 2 адсорбция и электрохимическая площадь поверхности [31, 32]. Cu 2 Катализатор O @ Au состоит из Cu 2 Наночастицы O и Au могут обеспечивать поверхность раздела металл-оксид для активации инертного CO 2 молекулы, повышают эффективность переноса заряда и увеличивают FE CO [33].
По сравнению с эффектом массопереноса полого кубического Au-катализатора, состоящего из наночастиц Au, синергетические взаимодействия оксидов металлов, образованных Cu 2 Кубики O и наночастицы Au более выгодны для преобразования CO 2 в CO через CO 2 электрохимическое восстановление.
Сравнение FE для CO и H 2 при - 1,0 В против RHE на Cu 2 Кубический катализатор, Cu 2 Катализатор O @ Au и полый кубический Au-катализатор показаны на рис. 6d. H 2 Соотношение / CO этих трех катализаторов составляет 3,9, 3,2 и 1,7. Cu 2 Коэффициент производства катализатора O @ Au равен 1,7 по CO 2 электрохимическое восстановление наиболее близко к синтез-газу (смесь CO и H 2 ) отношение 2 [34, 35]. Метод построения поверхности катализатора и доля продуктовых газов будут способствовать созданию высокоселективного CO 2 Катализаторы RR.
Средняя плотность тока трех катализаторов, которые были выполнены амперометрическим методом i - т , показана на рис. 7. С увеличением потенциала, как и ожидалось, очевидно увеличение плотности тока трех катализаторов. Разница средней полной плотности тока между полым кубическим Au (синяя сплошная линия) и Cu 2 O @ Au (черная сплошная линия) расширяется при -1,0 В. Однако разница средней полной плотности тока между полым кубическим Au и Cu 2 Куб O (красная сплошная линия) не отмечен в пределах от -0,7 до -1,1 В. Следовательно, мы можем сделать вывод, что эффективность переноса заряда Cu 2 Катализатор O @ Au выше, чем два других катализатора.
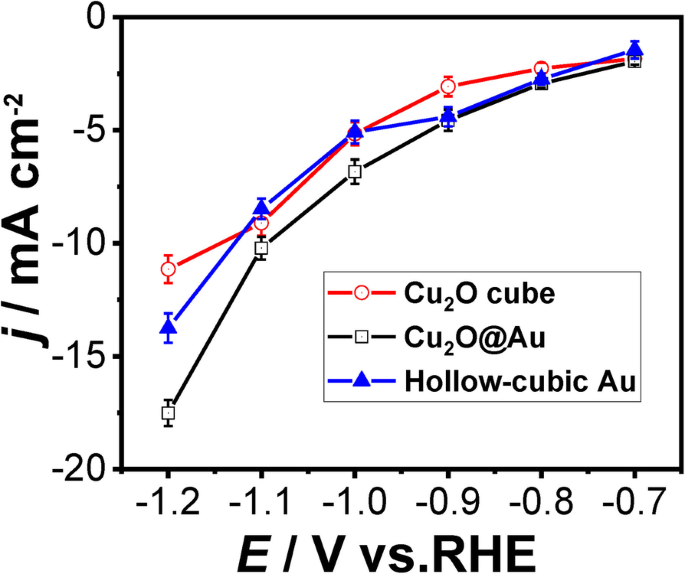
Средняя общая плотность тока трех катализаторов для CO 2 снижение при разных потенциалах
Выводы
Таким образом, электроды без поверхностно-активных веществ и с низким содержанием золота для CO 2 Электрохимическое восстановление готовили электроосаждением и GRR. Cu 2 Катализатор O @ Au показывает превосходную каталитическую активность по отношению к CO 2 RR, чем Cu 2 Кубы O и полый кубический Au-катализатор из-за границы раздела металл-оксид, то есть граница раздела металл-оксид может активировать инертный CO 2 молекулы поглощаются электродами. Для Cu 2 Катализатор O @ Au, он может преобразовывать CO 2 до CO с максимальным FE ~ 30,1% при -1,0 В, что примерно вдвое больше, чем у других катализаторов при том же потенциале. Добываемый газ Cu 2 Катализатор O @ Au с помощью CO 2 электрохимическое восстановление имеет H 2 Отношение / CO 1,7, что близко к соотношению синтез-газа в процессе Фишера-Тропша, равному 2. На основании этих результатов мы можем сделать некоторые выводы, что Cu 2 Катализатор O @ Au, изготовленный Cu 2 Кубики O и наночастицы Au могут образовывать границу раздела металл / оксид для активации инертного CO 2 молекул, и этот катализатор может быть использован для производства синтез-газа с помощью CO 2 электрохимическое восстановление.
Сокращения
- CO:
-
Окись углерода
- CO 2 :
-
Двуокись углерода
- CO 2 RR:
-
CO 2 реакция восстановления
- EDX:
-
Энергодисперсионное рентгеновское излучение
- GC:
-
Газовая хроматография
- GRR:
-
Реакция гальванической замены
- HCOO - :
-
Форматировать
- HER:
-
Реакция выделения водорода
- LSV:
-
Вольтамперометрия с линейной разверткой
- N 2 :
-
Азот
- RHE:
-
Реверсивный водородный электрод
- SEM:
-
Сканирующая электронная микроскопия
- XRD:
-
Рентгеновская дифракция
Наноматериалы
- Кубический цирконий
- Sensirion:миниатюрный датчик CO2
- Волоконный лазер против лазера CO2
- Исследования сорбции ионов тяжелых металлов с использованием нанокомпозитов из модифицированного железом б…
- Новые нанокомпозиты полистирола с полианилином, легированным лаурилсерной кислотой
- Морфологическая эволюция подложек Si с ямчатым рисунком (001) под действием снижения поверхностной энергии
- Является ли CO2 чистым агентом
- Сложности электрохимического измельчения
- Плюсы и минусы электрохимической резки
- Сжатый CO2 и сжатый воздух



