Изготовление и характеристика ZnO Nano-Clips с помощью процесса, опосредованного полиолом
Аннотация
Наноклипцы ZnO с лучшей монодисперсностью были успешно приготовлены с использованием гидрата ацетата цинка (Zn (OAc) 2 · NH 2 O) в качестве источника Zn и этиленгликоль (EG) в качестве растворителя с помощью простого процесса полиола на основе раствора. Влияние концентрации раствора на формирование наноклипсов ZnO глубоко исследовано. Сначала докажем, что 0,01 M Zn (OAc) 2 · NH 2 O может реагировать с EG без добавления воды или щелочи, образуя наноклипцы ZnO с поликристаллической структурой вюрцита при 170 ° C. Синтезированные наноклипцы ZnO содержат множество агрегированных нанокристаллов (от ~ 5 до 15 нм) с высокой удельной поверхностью 88 м 2 /г. Формы наноклипсов ZnO в основном остаются неизменными с улучшенной кристалличностью после отжига при 400–600 ° C. Более низкая концентрация раствора и небольшое количество H 2 O играют решающую роль в формировании наноклипсов ZnO. Когда концентрация раствора ≤ 0,0125 М, реакции комплексообразования и полимеризации между Zn (OAc) 2 · NH 2 Преобладают O и EG, в основном создавая наноклипцы из ZnO. Когда концентрация раствора ≥ 0,015 М, реакции алкоголиза и поликонденсации Zn (OAc) 2 · NH 2 O и EG становятся доминирующими, что приводит к образованию частиц ZnO сферической и эллиптической формы. Возможный механизм роста, основанный на конкуренции между комплексообразованием и алкоголизом Zn (OAc) 2 · NH 2 Было предложено O и EG.
Фон
Оксид цинка (ZnO) с прямой широкой запрещенной зоной 3,37 эВ и большой энергией связи возбуждения 60 мэВ в последние годы привлек большое внимание благодаря его применению в фотокатализаторах, солнечных элементах, а также в электрических и оптических устройствах [1,2 , 3,4,5,6,7,8,9,10]. ZnO имеет чрезвычайно многочисленные наноструктуры, такие как наносферы, наностержни, нанопроволоки и наноцветки [11,12,13,14,15,16]. Для создания наноструктур ZnO использовались различные методы синтеза [17,18,19,20,21,22]. Среди этих методов полиольный процесс на основе раствора демонстрирует огромные преимущества при получении неорганических соединений (металл, оксид, гидроксиацетат) благодаря уникальным характеристикам растворителей, таким как высокая температура кипения (до 250 ° C) и комплексообразование, восстановление и поверхностно-активное вещество. свойства, в дополнение к их амфипротическому характеру [23,24,25]. В последние десятилетия наночастицы ZnO различного размера и морфологии, полученные на основе полиол-опосредованного подхода, широко изучались. Параметры обработки полиола, температура реакции и концентрация, анион, гидролизное или щелочное соотношение и добавка имеют большое влияние на размер и морфологию частиц ZnO [11,12,13,14,15,16,17,18,19, 20,21,22,23,24,25,26,27,28,29,30,31]. Сферические частицы оксида размером 20–500 нм часто имеют морфологию при использовании этиленгликоля (EG) в качестве растворителя и Zn (OAc) 2 · 2H 2 O как источник цинка [23, 28, 30]. Было подтверждено агрегационное поведение нанокристаллических единиц ZnO с образованием поликристаллических сфер [18, 24, 26, 27].
В этой работе мы впервые успешно подготовили наноклипцы ZnO с помощью простого процесса полиола с гидратом ацетата цинка (Zn (OAc) 2 · NH 2 О, н <2) и EG без дополнительных H 2 О или другие добавки. Влияние концентрации раствора на морфологию было глубоко исследовано, и был предложен возможный механизм роста.
Методы
Все реагенты были аналитической чистоты и использовались без дополнительной очистки. 9,2 мг гидрата ацетата цинка (Zn (OAc) 2 · NH 2 О, н <2) растворяли в 5 мл этиленгликоля (EG) с получением около 0,01 моль / л (М) бесцветного раствора. Затем раствор нагревали на горячей плите до 170 ° C при перемешивании магнитной мешалкой в течение 1–3 ч. Раствор начал мутнеть через 6-7 мин с образованием флокул молочного цвета. По окончании реакции осадок центрифугировали, несколько раз промывали при 2000–3000 об / мин этанолом и деионизированной водой (объемное соотношение 4:1) и сушили при комнатной температуре в течение ночи для структурной и морфологической характеристики. Некоторые образцы были также отожжены при 400 и 600 ° C в течение 2 ч в трубчатой печи со скоростью нарастания 2 ° C / мин на воздухе. Растворы с различным Zn (OAc) 2 · NH 2 Концентрации O 0,005, 0,125, 0,015, 0,05 и 0,2 М также были приготовлены для исследования влияния концентрации раствора.
Кристалличность и фазы образцов оценивали на рентгеновском дифрактометре (D / max 2000, Rigaku) с использованием Cu kα-излучения ( λ =1,5405 Å). Морфологические наблюдения выполняли с помощью сканирующей электронной микроскопии (SEM; Quanta ™ 50, FEI) и просвечивающей электронной микроскопии (TEM; Tecnai G2 F20, Philips). Термическую стабильность образцов после приготовления характеризовали термогравиметрически-дифференциальным термогравиметрическим анализом (TG-DTG; STA 409 PC, Netszch) в потоке воздуха со скоростью нагрева 20 ° C / мин. Инфракрасные спектры с преобразованием Фурье (FTIR) свежеприготовленных и отожженных образцов собирали в диапазоне 4000–400 см - 1 спектрометра FTIR (FTIR; Spectrum, PerkinElmer) с использованием прессованных таблеток KBr. Удельную поверхность Брунауэра-Эммета-Теллера (БЭТ) оценивали с помощью прибора для измерения площади поверхности (TriStar-3000, Micromeritics). Кроме того, оптические свойства отожженного образца также были измерены с помощью спектрофотометра в ультрафиолетовых, видимых и ближних инфракрасных лучах (УФ – видимая – БИК) (UV-3600, Shimadzu).
Результаты и обсуждение
Морфология ZnO Nano-Clips
На основании некоторых литературных источников [23, 28, 30] наночастицы ZnO сферической или эллиптической формы могут быть сформированы в растворителе ЭГ с использованием Zn (OAc) 2 · 2H 2 O в качестве источника цинка при 160 или 198 ° C. Однако в наших условиях обработки 5 мл 0,01 M Zn (OAc) 2 · NH 2 Раствор O при температуре реакции 170 ° C, 2 ч без добавления H 2 O, ZnO нано-зажимы с лучшей монодисперсией были изготовлены с помощью простого полиольного процесса, как показано на рис. 1. Образцы, которые были приготовлены в свежеприготовленном виде, имеют четкую морфологию зажимов с большим количеством зажимов и небольших наночастиц (рис. 1а). После отжига 600 ° C морфология практически не меняется (рис. 1б). Мы также выполнили наблюдения ПЭМ и ПЭМ высокого разрешения (ПЭМВР) на отожженных образцах ZnO при 400 ° C, как показано на рис. 1c. И снова можно наблюдать морфологию наноклипов. На основе изображений ПЭМВР с локальным увеличением образцов при 400 ° C можно заметить, что зажимы ZnO состоят из множества агрегированных нанокристаллов (от ~ 3 до 15 нм) с поликристаллической структурой. На рисунке 1d изображен эскизный чертеж одного нанозажима ZnO шириной (W) 50–100 нм, длиной (L) ~ 1–3 мкм и диаметром (D) 10–30 нм. Хотя ZnO имеет чрезвычайно большое количество наноструктур, такая морфология, как нанозажим, все еще очень уникальна и нова, насколько нам известно, о чем не сообщалось, особенно с помощью простого подхода, опосредованного полиолом.

СЭМ-изображения ( a ) в готовом виде и ( b ) Отожженные при 600 ° C образцы наноклипсов ZnO. ПЭМ-изображения ( c ) Нанозажимы ZnO, отожженные при 400 ° C. Вставки ( c ) - соответствующие изображения ВРЭМ местного увеличения. ( д ) Эскизная схема нанокрепа ZnO
Структура ZnO Nano-Clips
На рис. 2а показаны рентгеновские дифрактограммы (XRD) отожженных при 400 и 600 ° C наноклипсов ZnO в исходном состоянии. Приготовленные зажимы из ZnO в основном кристаллизовались с гексагональной фазой вюрцита (JCPDS36-1451). Довольно много пиков XRD происходит от плоскостей (100), (002), (101), (102), (110), (103), (112) и (201), что указывает на поликристаллическую природу наноклипсов ZnO. , что хорошо согласуется с приведенными выше результатами ПЭМВР (рис. 1в). После отжига при 400 и 600 ° C эти рентгеновские дифрактометры становятся прочнее и острее, что свидетельствует о повышенной кристалличности. На основе полной ширины на полувысоте (FWHM) трех более сильных пиков (101), (100) и (002), средний размер кристаллитов наноклипов в синтезированном виде при 400 и 600 ° C рассчитывается как примерно 11,5, 21,0 и 24,8 нм, соответственно, с использованием уравнения Шеррера. Очевидно, отжиг значительно улучшает кристалличность наноклипсов ZnO и увеличивает средний размер нанокристаллов, образующих нанозажимы. Однако, основываясь на большом количестве наблюдений SEM, не наблюдается значительных изменений в морфологии и размере наноклипсов.
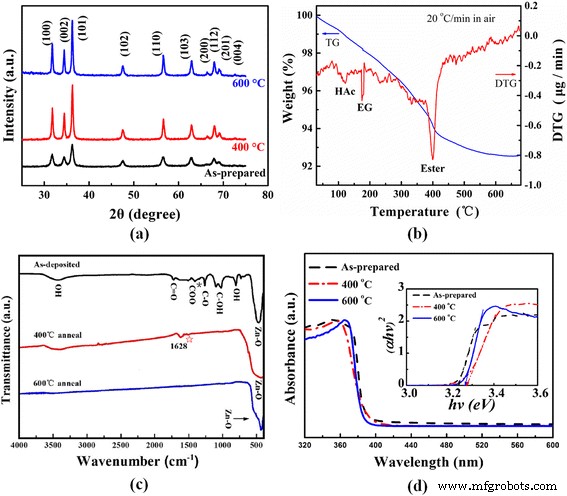
( а ) Рентгенограммы предварительно приготовленных образцов наноклипсов ZnO, отожженных при 400 и 600 ° C. ( б ) Кривые ТГ-ДТГ готовых наноклипсов ZnO, нагретых на воздухе. ( c ) ИК-Фурье-спектры исходных, отожженных при 400 и 600 ° C образцов наноклипсов ZnO. ( д ) УФ – видимый спектр поглощения предварительно приготовленных образцов наноклипсов ZnO, отожженных при 400 и 600 ° C. Вставка в ( d ) является соответствующей кривой ( αhv ) 2 зависимость от hv
На рисунке 2b представлены кривые TG-DTG для свежеприготовленных наноклипсов ZnO при скорости нагрева 20 ° C / мин на воздухе до 700 ° C. Кривая DTG показывает три пика потери веса при температуре около 118, 180 и 400 ° C, связанных с улетучиванием уксусной кислоты и EG, а также сильным разложением и горением сложного эфира, соответственно. Кривая ТГ подтверждает небольшую потерю веса (~ 7%) от комнатной температуры до 600 ° C. После 600 ° C вес в основном остается неизменным благодаря полному удалению органических частиц в наноклипах ZnO, в соответствии со следующим результатом FTIR образца ZnO, отожженного при 600 ° C (рис. 2c).
На рис. 2с показаны ИК-Фурье-спектры предварительно отожженных образцов ZnO с нанозажимами в исходном состоянии при 400 и 600 ° C. Готовый продукт показывает несколько полос поглощения, которые приписываются некоторым органическим группам или ZnO. Полоса сильной адсорбции при 400–600 см - 1 возникает из-за моды валентных колебаний Zn – O в области низких волновых чисел, что свидетельствует об образовании ZnO. Пик на отметке 800 см - 1 относится к моде валентных колебаний связи ОН в спирте, а полоса поглощения в диапазоне 1020–1090 см - 1 принадлежит связи C – OH, что указывает на то, что образцы в исходном состоянии содержат небольшое количество полиола. Пики на 1260 и 1727 см - 1 возникают в результате валентного колебания связей C – O и C =O, что подразумевает присутствие сложного эфира или гликолата в готовых соединениях. Две полосы поглощения примерно при 1587 и 1413 см - 1 соответствуют асимметричным и симметричным валентным колебаниям C =O и C – O в ацетатных (COO) группах соответственно [3, 20, 26]. Расщепление асимметричных и симметричных полос валентных колебаний карбоксилата (Δ) в диапазоне 130–200 см - 1 типичен для мостиковых комплексов [32]. Здесь значение Δ 174 см - 1 предлагает режим мостиковой связи в синтезированных наноклипах ZnO. Кроме того, небольшой пик поглощения (обозначен *) при 1343 см - 1 происходит из-за слабосвязанных молекул уксусной кислоты, что позволяет предположить, что небольшая уксусная кислота адсорбируется на поверхности синтезированных наноклипсов ZnO, что согласуется с предыдущими сообщениями [11, 26].
После отжига при 400 ° C, за исключением чрезвычайно слабого пика поглощения (обозначенного ☆) при 1587 см - 1 Из C =O другие полосы ИК-поглощения от HAc, сложного эфира и EG исчезли, что согласуется с результатами TG-DTG на рис. 2b. Кроме того, полоса поглощения при 1628 см - 1 приписывается изгибным колебаниям гидратации или адсорбции воды [26]. Слабая широкая полоса в диапазоне высоких волновых чисел 3440 см - 1 подтверждает наличие гидроксильной группы на поверхности оксида металла как до, так и после отжига при 400 ° C. После отжига при 600 ° C органические соединения и гидроксильная группа полностью удаляются. Только прочная тесьма на 434 см - 1 от Zn – O можно наблюдать валентные колебания, указывающие на образование чистого ZnO при 600 ° C. Сдвиг и расширение пика Zn – O после отжига при 400 и 600 ° C может быть связано с улучшенной кристалличностью, размером кристаллитов и уменьшением количества органических частиц / примесей.
Оптические свойства и удельная площадь поверхности ZnO Nano-Clips
На рис. 2d показаны спектры поглощения в УФ и видимой областях отожженных образцов ZnO с нанозажимами в исходном состоянии при 400 и 600 ° C. На вставке в (d) показаны соответствующие кривые ( αhv ) 2 зависимость от hv . Сильное поглощение происходит ниже 390 нм.
Прямая запрещенная зона (Eg) ZnO может быть оценена как ( αhv ) 2 = c ( hv - Например ) [33], где α - коэффициент поглощения, а hv - энергия кванта излучения. Расчетная ширина запрещенной зоны исходных образцов ZnO при 400 и 600 ° C составляет 3,24, 3,28 и 3,27 эВ, соответственно, что соответствует 3,2 эВ для наночастиц ZnO, полученных при синтезе полиола [28]. Почему ширина запрещенной зоны сначала увеличивается, а затем немного уменьшается с увеличением температуры отжига? Мы думаем, что это будет связано с несколькими факторами. С одной стороны, ширина запрещенной зоны наноматериалов уменьшается с увеличением размера нанокристаллов. С другой стороны, кристаллические порошки имеют большую ширину запрещенной зоны, чем аморфные. Между тем, уменьшенная примесь углерода в оксиде металла может увеличить ширину запрещенной зоны. На основании результатов XRD и FTIR образцы ZnO при 400 ° C показали лучшую кристалличность и более низкое содержание углерода. Хотя размер нанокристаллов в наноклипцах ZnO при 400 ° C становится больше, преобладают явно улучшенная кристалличность и уменьшенная примесь углерода, что приводит к увеличению ширины запрещенной зоны. При дальнейшем отжиге при 600 ° C небольшое уменьшение ширины запрещенной зоны в основном объясняется эффектом размера зерна.
Удельная поверхность полученного нанокрепца ZnO составляет около 88 м 2 . /г. После отжига 400 ° C она уменьшается до ~ 59 м 2 / г, что связано с увеличением размера кристаллитов, повышенной плотностью зерен, а также уменьшением пор и дефектов после термической обработки [26].
Влияние концентрации раствора на морфологию ZnO
Чтобы исследовать влияние концентрации реагента на образование и морфологию образцов ZnO с помощью процесса полиола, Zn (OAc) 2 · NH 2 Концентрация раствора О варьировалась от 0,005 до 0,01, 0,0125, 0,015, 0,05 и 0,2 М, фиксируя другие параметры реакции. Когда Zn (OAc) 2 · NH 2 Концентрация раствора O составляет 0,005, 0,01 и 0,0125 М, нанозажимы ZnO могут быть обработаны небольшими наночастицами, как показано на рис. 1b. При увеличении концентрации раствора до 0,015 М наноклипцы ZnO исчезают, и на рис. 3а могут образовываться только наночастицы ZnO эллиптической формы (~ 435 × 200 нм), аналогично предыдущим литературным результатам [25, 28, 30]. При дальнейшем увеличении концентрации раствора до 0,05 М на СЭМ-изображении видна смесь эллиптических (~ 220–260 × 100–140 нм) или сферических (100–260 нм) частиц с агрегатами неправильной формы в несколько микрометров на рис. 3б. Более того, реакция ускоряется с увеличением концентрации раствора. Время помутнения раствора сокращается с 7 минут при 0,01 M до 4,5 минут при 0,2 M. Продукты ZnO в концентрации 0,2 M демонстрируют более беспорядочную агрегатную морфологию с небольшими сферами размером ~ 30 нм.

СЭМ-изображения образцов ZnO в различных условиях ( a ) 0,015 M, 5 мл и 170 ° C и ( b ) 0,05 M, 5 мл и 170 ° C
Возможный механизм роста ZnO Nano-Clips
Чтобы выяснить возможный механизм роста образования наноклипсов ZnO, мы также выполнили SEM-наблюдения за полученным ранним осаждением ZnO во время реакции 12 мин из 0,01 М раствора при 170 ° C. На рис. 4 показаны СЭМ-изображения образцов ZnO с различным временем реакции:12 мин и 2,5 ч.

СЭМ-изображения образцов ZnO из 0,01 M Zn (OAc) 2 · nH 2 O при 170 ° C со временем реакции ( a - c ) 12 мин и ( д - е ) 2,5 ч. Вставка ( c ) - местное увеличение морфологии нанокольца
При малом увеличении (× 5000) образцы ZnO, полученные через 12 мин и 2,5 ч, демонстрируют сходную морфологию с перьевидными агрегатами на рис. 4a, d. При дальнейшем увеличении увеличения (× 50 000) для 12-минутного образца мы не можем наблюдать четкие детали и детали на рис. 4b; однако для образца продолжительностью 2,5 часа накопленные нанокрепки хорошо видны на рис. 4e. Стоит отметить, что ранняя морфология нанозажима, такого как нанокольцо или полукольцо, была обнаружена в 12-минутном образце на рис. 4c. Это важный намек для объяснения механизма образования наноклипсов ZnO. Кроме того, мы также распознаем некоторые части наноклипсов в 2,5-часовом образце, такие как нанопроволока, наностик и незамкнутый зажим на рис. 4f.
В нашем процессе подготовки наноклипсов ZnO Zn (OAc) 2 · NH 2 Концентрация раствора О составляет 0,01 М и явно ниже, чем в большинстве литературных источников [23, 24, 28,29,30]; Между тем, в 5 мл растворителя EG не добавляется дополнительная вода или щелочь, такая как NaOH или блокирующий агент поливинилпирролидон (PVP). Кроме того, используемый нами источник Zn содержит относительно меньше воды гидрата ( n <2) из-за потери воды из-за длительного хранения. Возможное образование наноклипсов ZnO можно описать следующим образом:
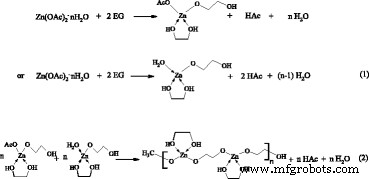
Во-первых, Zn (OAc) 2 · NH 2 O растворяется в растворителе EG примерно за 1 мин при 170 ° C. Гидрат ацетата цинка реагирует с EG и образует промежуточный предшественник алкоксиацетатного комплекса, такой как Zn (OAc) (OCH 2 Канал 2 ОН) x путем частичной замены анионов ацетата и молекул воды (уравнение 1), что подтверждается спектрами FTIR на рис. 2c. Образование координационных связей между Zn 2+ а растворитель диэтиленгликоль (ДЭГ) и ЭГ также наблюдался в нескольких предыдущих работах [24, 28, 29]. Poul et al. обнаружили наличие алкоксиацетатного комплекса Zn (OAc) 3 (ОСН 2 Канал 2 OH) и Zn 3 (OAc) 4 (O (CH 2 ) 2 O (CH 2 ) 2 O) [34, 35]. Впоследствии алкоксиацетатные комплексы продолжают полимеризоваться и образовывать линейный полимер (уравнение 2). Ацетат и EG действуют как мостиковый лиганд, позволяющий протекать полимеризации. Спектры FTIR свежеприготовленных наноклипсов ZnO также демонстрируют режим мостиковой связи на рис. 2c. Здесь линейный полимер, точно так же, как шаблон, вызывает рост нанокристаллов ZnO вдоль длинной цепи за счет термического разложения или медленного гидролиза, чтобы получить нанопроволоку и нанокольцо ZnO. После достаточного времени реакции (≥ 1 ч) наноклипцы ZnO из нанопроволоки и нанокольца ZnO наконец образуются, как показано на рис. 5a.
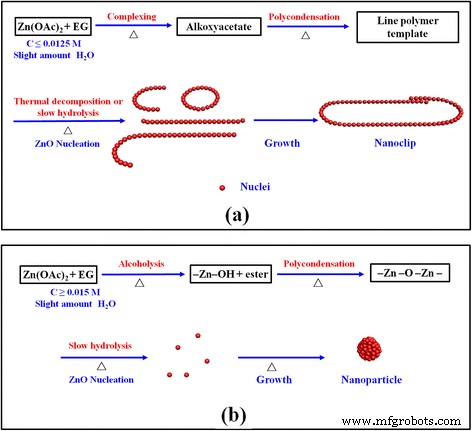
Схема эволюции ( a) Нанозажим ZnO и ( b ) Образование частиц ZnO двумя возможными способами, опосредованными полиолом
Влияние других параметров обработки, таких как температура реакции, добавки, растворитель, такой как ПВП, и источники Zn, на образование наноклипсов ZnO показано в дополнительном файле 1. Реакция негидролитического алкоголиза между Zn (OAc) 2 · NH 2 О и ЭГ начинают преобладать при изготовлении нанокристаллов ZnO [36, 37]. H 2 Количество O и OH - концентрация имеет важное влияние на морфологию и размер зерен продуктов ZnO, опосредованных полиолом [23, 24, 27, 28, 29, 30]. Высокая степень гидролиза (> 50) в ЭГ приводит к образованию гидроксиацетата [23]. Согласно литературным данным [23, 24, 26], гидроксиацетат способствует образованию наночастиц ZnO в этих условиях. –Zn – OH образуется путем алкоголиза, основанного на реакции элиминирования сложного эфира (уравнение 3), затем поликонденсация –Zn – OH и –Zn – O – Ac или –Zn – OH приводит к прогрессивному развитию Ядра ZnO путем отщепления уксусной кислоты или H 2 O (уравнения 4 и 5), что может сопровождаться медленной реакцией гидролиза [28]. Уравнение 5 эквивалентно принудительной гидроконденсации, предложенной Gaudon et al. [27]. Наконец, зародыши ZnO увеличиваются в размерах, образуя нанокристаллы ZnO. Эти нанокристаллы объединяются в сферические или эллиптические наночастицы, как показано на рис. 5b. Он конкурирует между двумя видами маршрутов реакции полиола наряду с изменением параметров обработки.
Выводы
Впервые интригующие наноклипцы ZnO с лучшей монодисперсией были приготовлены простым способом, опосредованным полиолом. Влияние концентрации раствора на формирование наноклипсов ZnO глубоко исследовано. Докажем, что Zn (OAc) 2 · NH 2 O может реагировать с EG без добавления воды или щелочи, образуя чистую фазу ZnO с поликристаллической структурой вюрцита при 170 ° C. Форма наноклипсов ZnO остается постоянной с улучшенным качеством кристаллизации после отжига при 400–600 ° C. Возможный механизм роста, основанный на конкуренции между комплексообразованием и алкоголизом между Zn (OAc) 2 · NH 2 O и EG было предложено. Когда концентрация раствора составляет ≤ 0,0125 M в 5 мл раствора при 170 ° C, преобладают реакции комплексообразования и полимеризации, в основном с образованием наноклипсов ZnO. Когда концентрация раствора составляет ≥ 0,015 М, реакции алкоголиза и поликонденсации становятся доминирующими, что приводит к образованию частиц ZnO сферической или эллиптической формы. Благодаря особым наноструктурам и большей удельной поверхности наноклипцы ZnO являются многообещающим материалом в качестве фотокатализатора для разложения вредных загрязнителей в сточных водах и газах, анодного материала литиевой батареи или суперконденсатора для электрохимического накопления энергии, а также датчика для обнаружения опасного газа.
Сокращения
- СТАВКА:
-
Брунауэр-Эмметт-Теллер
- DEG:
-
Диэтиленгликоль
- Пример:
-
Этиленгликоль
- FTIR:
-
Инфракрасные спектры с преобразованием Фурье
- FWHM:
-
Полная ширина на половине максимальной
- HRTEM:
-
Просвечивающая электронная микроскопия высокого разрешения
- NIR:
-
Ближний инфракрасный луч
- PVP:
-
Поливинилпирролидон
- SEM:
-
Сканирующая электронная микроскопия
- ТЕМ:
-
Просвечивающая электронная микроскопия
- TG-DTG:
-
Термогравиметрия-дифференциальная термическая гравитация
- UV:
-
Ультровиолет
- XRD:
-
Рентгеновская дифракция
Наноматериалы
- Каковы красители и процесс окрашивания?
- Блог:понимание процесса изготовления PDMS
- Разница между автоматизацией роботизированных процессов и автоматизацией тестирования
- Понимание точности и процесса технологии лазерной резки
- В чем разница между изготовлением металла и сваркой металла?
- В чем разница между изготовлением металла и сваркой?
- Процесс литья бронзы и его применение
- Разница между традиционным и нетрадиционным процессом обработки
- Процесс проектирования и внедрения автоматизации производства
- Понимание обработки и производства пластмасс



